Jean-Marc Stéphan
Electroacupuncture dans la régénération axonale : intérêt dans les séquelles de traumatismes vertébro-médullaires
Résumé : Les traumatismes vertébro-médullaires posent le problème des séquelles à type de paralysie avec douleurs chroniques et incontinences. Une certaine récupération est obtenue par lutilisation combinée de différentes stratégies thérapeutiques associant neuroprotection et régénération axonale par pontage de greffes cellulaires diverses. Des essais contrôlés randomisés ont objectivé que lélectroacupuncture (EA) offre également une efficacité dans les paraplégies au niveau des algies et de la récupération motrice mesurées par la classification ASIA. Chez lanimal, lEA inhibe la GFAP (Glial fribrillary acidic protein), lepidermal growth factor receptor (EGFR), lexpression de laquaporine (AQP-4), régule le superoxide dismutase (SOD), le malondialdehyde (MDA), les enzymes (acétylcholinestérase, succinate dehydrogenase, phosphatase acide), augmente la production de lexpression de la laminine et des endorphines et diminue le taux de cortisol. En outre, le flux sanguin au niveau de la moelle serait accru. LEA associée à la transplantation de cellules souches de moelle osseuse pourrait être une voie davenir, car accélérant la récupération axonale davantage que lEA seule ou le pontage de greffes cellulaires en traitement unique. Chez lanimal et au niveau de la lésion, elle entraîne des mécanismes physiopathologiques impliquant une action sur le greffon avec différenciation en neurones-like grâce notamment à la production de neurotrophine 3 (NT-3), AMP cyclique et de calcitonin gene-related peptide (CGRP). Mots-clés : électroacupuncture régénération axonale GFAP EGFR aquaporine neurotrophine 3 laminine flux sanguin.
Summary: The spinal cord injuries raises the problem of the
sequelae including paralysis with chronic pain and incontinences. A certain
recovery is obtained by the various combinatorial treatments associating
neuroprotection and axonal regeneration by cellular transplants of various
cells types. Randomized controlled trials show that the electroacupuncture also
may significantly improve paraplegias for the pain and the motor recovery
measured by the ASIA classification. In animal models, the electroacupuncture
(EA) inhibits the GFAP (Glial fribrillary acidic protein), the epidermal growth
factor receptor (EGFR), expression of aquaporin (AQP-4), regulates superoxide
dismutase (SOD), malondialdehyde (MDA), enzyms (acetylcholinesterase, succinate
dehydrogenase, acid phosphatase), increases the production of laminin
expression and endorphins and decrease the level of 17-hydroxycorticosterone.
Besides, the blood flow in the marrow would be increased. The EA combined with
bone marrow mesenchymal stem cells could be a path to future, because
accelerating the axonal recovery more than the EA or cell transplantations
treated alone. In animal models and about level with the injury, EA leads to
physiopathological mechanisms meaning an effect on the transplant with differentiation
into neuron-like cells due to the production of neurotrophin 3 (NT-3), cyclic
AMP and calcitonin gene-related peptide (CGRP). Keywords:
electroacupuncture - axonal regeneration - GFAP-EGFR - aquaporin - neurotrophin
3 laminin blood flow.
La prévalence dindividus présentant des lésions de moelle épinière aux USA est denviron 250000 personnes avec 12000 nouveaux cas par an [[1]]. Les conséquences personnelles de ces lésions neurologiques sont incalculables et dévastatrices entraînant de substantielles dépenses sociales directes et indirectes, qui résultent des séquelles (paralysie, perte sensorielle, douleur chronique, escarres de décubitus et incontinence vésicale ou fécale).
Les stratégies dintervention sont axées sur la neuroprotection, la régénération axonale (prévention des cicatrices gliales, blocage des inhibiteurs de régénération et apports de supports trophiques) et activation du segment sous-lésionnel.
Il était établi depuis le 19ème siècle que les nerfs du système nerveux central, en particulier la moelle épinière, ne se régénèrent pas spontanément après interruption de leurs axones, au contraire des nerfs du système périphérique qui peuvent se reconnecter avec les organes cibles. Cest en 1830 que Schwann montre pour la première fois que les fibres nerveuses dun nerf sciatique de lapin sont capables de repousser après une interruption. En 1928, en Espagne, Ramon y Cajal qui analyse la repousse des nerfs du SNC note que les fibres ébauchent un bourgeonnement mais qui ne se pérennise pas [[2]]. Cest à partir des années 1980 quAguayo objective que des transplants de nerfs périphériques sont capables dinduire un environnement physico-chimique favorable à la régénération du SNC [[3]]. Lincapacité intrinsèque de régénération du SNC est modifiable, à condition dagir à différents niveaux du processus de lésion neurologique. En 1990, des travaux américains identifient des molécules de la matrice extracellulaire, les protéoglycanes, entraînant une "cicatrice gliale", structure cellulaire désorganisée impliquant les cellules non-neuronales se formant autour des lésions de la moelle épinière, et constituant une barrière à la régénération [[4],[5]].
Ainsi, les déficits fonctionnels après lésion de moelle épinière résultent des dommages neuronaux avec démyélinisation des axones et un dysfonctionnement des cellules de la névroglie. L'échec de la régénération axonale après lésion de la moelle a été attribuée à un environnement contenant des médiateurs inflammatoires, un manque de support neurotrophique et des molécules inhibitrices. Des stratégies thérapeutiques ont essayé de promouvoir la régénération axonale incluant le «pontage» de la zone contuse en utilisant des transplants cellulaires qui peuvent faire appel à de nombreux variétés de cellules : cellules de Schwann [[6],[7]], cellules gliales engainantes du bulbe olfactif (OEGC) [[8],[9]], cellules souches (moelle osseuse, cellules embryonnaires) [[10],[11],[12],[13]], cellules génétiquement modifiées [[14],[15],[16]], mais aussi utilisation de facteurs de croissance, comme le Glial cell line-derived neurotrophic factor (GDNF) [[17]], voire utilisation combinée de ces différentes stratégies thérapeutiques [[18],[19],[20],[21],[22],[23]]. Linjection dAMPc dans les neurones sensitifs favorise aussi une régénération axonale [[24],[25]]. L'AMP cyclique est un intermédiaire essentiel dans les cascades de voies de transduction intracellulaires et agit souvent en tant que second messager, dans l'action des hormones ou des neurotransmetteurs notamment.
La co-implantation de cellules de Schwann et de cellules souches nerveuses dans une moelle épinière lésée par section complète ou hémi-section permettait un rétablissement significatif dans certaines circonstances [[26]]]. Mais des problèmes éthiques inhérents à lobtention des cellules souches nerveuses à partir des tissus ftaux, ainsi que des problèmes dhistocompatibilité font quon leur préfère les cellules souches mésenchymateuses de moelle osseuse [27,28].
Lutilisation des transplants cellulaires en association avec lélectroacupuncture semble également améliorer la régénération axonale comme le laisse supposer certains travaux dacupuncture expérimentale. Peut-être une nouvelle approche dans le traitement des séquelles de traumatismes vertébro-médullaires ?
Essais cliniques
De nombreuses études chinoises objectivent
une amélioration de la symptomatologie des paraplégies traumatiques de la
moelle épinière [29-34 ]. Malheureusement, la plupart de ces études résultent
de travaux écrits en langue chinoise ou dont lévaluation méthodologique reste
difficile à apprécier [
[29]
]. Une étude de cas française concernant une paraplégie
flasque incomplète ne trouvait pas defficacité sur la motricité, ni sur la
vessie neurologique mais considérait l'acupuncture comme une des méthodes
additionnelles ayant une influence significative sur le confort psychologique
du patient en soulageant les douleurs et en diminuant le stress [35].
Deux études ont dailleurs montré
une amélioration des algies en rapport avec un traumatisme de la moelle
épinière [[36],[37]],
mais elles sont de qualité méthodologique insuffisante avec un score de Jadad
respectivement de 0 et 1 [[38]].
Seul, lessai contrôlé randomisé de Dyson-Hudson [[39]],
dexcellente qualité méthodologique (Jadad 5/5) montre une efficacité
statistiquement significative (p=0,005) sur les douleurs des épaules. Cependant
le résultat est à tempérer dune part parce que lECR est de faible puissance
(n=17) et aussi parce que lefficacité est également retrouvée dans le groupe
dacupuncture placebo. Sur lincontinence intestinale et le dysfonctionnement
vésical, quelques études ont montré aussi lefficacité de lacupuncture ou
électroacupuncture [[40],[41]].
Mais là encore, ce sont des études de faible qualité méthodologique (Jadad 1 à
2).
Ainsi Wong et coll. [[42]] ont montré que lélectroacupuncture
(EA) associée à lauriculothérapie utilisée précocement suite à un traumatisme
de la moelle épinière pouvait contribuer à une amélioration significative des
fonctions neurologiques. Cet essai portait sur cent sujets ayant une lésion
traumatique de la moelle épinière (37 quadriplégiques / 63 paraplégiques au
niveau A ou B à léchelle ASIA) randomisés en deux groupes. Cinquante sujets
bénéficiaient de soins standards de rééducation tandis que les cinquante autres
bénéficiaient en plus de l'EA des points 3IG (houxi) et 62V (shenmai)
(stimulation de style TENS par électrode de surface de 4 x 5 cm2) à
une fréquence de 75 Hz associée à de lacupuncture auriculaire cinq fois par
semaine pendant 30 minutes. Houxi est le point maître du merveilleux
vaisseau dumai (Vaisseau Gouverneur), couplé au yangqiaomai dont
le 62V est le point clé. D'où l'intérêt de piquer ensemble 3IG et 62V. Le
groupe EA avait une amélioration neurologique statistiquement significative à
un an, par rapport au groupe ayant une rééducation standard. Léchelle de
lAmérican Spinal Injury Association (ASIA) qui donne un niveau et un score de
sensibilité et de motricité allant du niveau E (motricité et sensibilité
normale) à A (motricité et sensibilité abolie complètement) (figure 1) a été
utilisée.
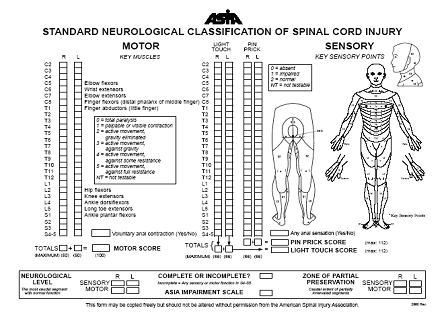
Figure 1. Classification de lASIA
évaluant la motricité et la sensibilité des lésions de la moelle épinière.
On constate que les scores moteurs ASIA dans le groupe EA sont significativement améliorés par rapport au groupe témoin (74,2 versus 52,3 de moyenne p<0,05), tout comme la sensibilité épicritique testée à lépingle (90,0 versus 69,8, p<0,05) ou tactile fine (92,5 versus 70,5 p<0,05) entraînant un meilleur score fonctionnel (106,9 contre 88,7 p<0,05). Dans le groupe témoin 32 personnes (64 %) restèrent au niveau A ou B à léchelle ASIA un an après la lésion, huit (16 %) passèrent au niveau C, six (12 %) améliorés en ASIA D et quatre (8%) améliorés en ASIA E (7). Au contraire, le groupe EA a montré de meilleurs résultats neurologiques. Seulement onze personnes (22 %) restèrent au niveau A ou B un an après la lésion tandis que dix (20%) furent améliorées au niveau C, 8 (16%) au niveau D et 21 (42%) améliorés au niveau ASIA E.
L'étude de Wong et coll. suggère un effet plus grand de l'électroacupuncture sur le rétablissement neurologique, le dysfonctionnement vésical et lincontinence fécale des traumatismes aigus de moelle épinière que n'importe quelle intervention pharmacologique.
Cette étude de référence devrait être confirmée par un autre essai contrôlé randomisé et, si ces résultats impressionnants sont retrouvés, alors ce traitement devrait être intégré dans la gestion des traumatismes vertébro-médullaires. En effet, cette étude est malheureusement de qualité méthodologique médiocre, avec un score de Jadad 2/5 (la randomisation est citée mais non décrite et létude non en double insu), même si les données observées montrent que les sujets entrés dans létude sont conformes à une bonne répartition en terme dâge, de distribution masculine ou féminine, de tétraplégie ou dhémiplégie et de durée dévolution du traumatisme de la moelle.
Ainsi, lapproche thérapeutique par lélectroacupuncture dans les séquelles des traumatismes médullaires ne doit pas être négligée, car peut sappuyer sur des études physiopathologiques expérimentales pouvant expliquer son mécanisme daction.
Acupuncture expérimentale : possibles mécanismes des effets de lélectroacupuncture
Lélectroacupuncture va agir à plusieurs niveaux : prévention et réduction des cicatrices gliales, neuroprotection avec diminution de ldème lésionnel, régénération axonale, réduction des douleurs et du stress.
Réduction des cicatrices gliales
Protéine gliofibrillaire acide (GFAP : Glial fribrillary acidic protein)
Suite à une lésion, une cicatrice gliale caractérisée par une hyperplasie et une hypertrophie des astrocytes se forme rapidement (dès 24 heures après la lésion). Ces astrocytes dit réactifs possèdent de nombreux prolongements qui vont envelopper les structures neuronales, empêchant la restauration de la barrière hémato-encéphalique. De plus, ces cellules qui sont caractérisées par un taux élevé de protéine gliofibrillaire acide (GFAP), participeraient à la phagocytose des débris cellulaires issus de la lésion, et combleraient les espaces extracellulaires vides laissés suite à la dégénérescence des cellules neuronales et gliales. Lélectroacupuncture peut réduire les taux de la GFAP dans les lésions de la moelle épinière et donc diminue la formation de la cicatrice gliale. Cela a été démontré chez les rats par stimulation des points du Vaisseau Gouverneur : lélectroacupuncture inhibe la prolifération des astrocytes et lexpression de lARNm du GFAP est significativement diminuée par rapport au groupe contrôle [[43]]. Une autre étude concernant 45 rats avec lésion de la moelle épinière répartis de manière aléatoire en trois groupes de 15 (contrôle, modèle et électroacupuncture) a objectivé une amélioration de la locomotion des pattes arrières, associée à une diminution statistiquement significative (p<0,01) de la GFAP dans le groupe électroacupuncture (EA à 2Hz, 2-6mA) par rapport aux deux autres groupes, promouvant donc une régénération axonale [[44]].
Epidermal growth factor receptor (EGFR) (récepteur de croissance épidermique)
La même étude de Peng et coll. objective en outre une diminution statistiquement significative (p<0,01) de lexpression de lEGFR par lélectroacupuncture à 2Hz appliquée aussi sur les points huatuojiaji au niveau de la 10ème vertèbre thoracique (au niveau de la lésion de moelle) pendant 30mn durant 3, 7 et 14 jours. LEGFR appartient à la famille des récepteurs membranaires erbB. LEGFR est une glycoprotéine transmembranaire monomérique. Par son domaine extracellulaire, lEGFR se lie à des ligands spécifiques comme lEGF et le TGF-α, deux ligands extracellulaires endogènes majeurs. La formation de dimères conduit à lactivation du domaine intrinsèque tyrosine kinase. La phosphorylation et la déphosphorylation protéique, catalysées par des protéines kinases (comme la tyrosine kinase) et phosphatases, représentent des événements biochimiques pour la transduction intracellulaire du signal. Lactivation des tyrosines kinases entraîne lautophosphorylation des résidus tyrosine du domaine cytoplasmique C-terminal du EGFR. Une cascade de signaux intracellulaires est ainsi initiée. Les voies de transduction du signal du EGFR font intervenir les voies biochimiques de Ras/MAPKinase, de la phosphatidyl inositol 3-kinase, dAkt, de la protéine kinase C et de la phospholipase D. On sait déjà que lacupuncture intervient dans cette transduction par la mécanotransduction [[45],[46]]. Les réponses biologiques du EGFR sont pléiotropiques. Elles incluent la mitose, lapoptose, laltération, la motilité cellulaire, la sécrétion protéique, la différenciation ou la dédifférenciation. Ainsi, la signalisation par lEGFR mène à une diversité de réponses, qui sont sous la dépendance de mécanismes complexes de régulation. LEGFR, sur-exprimé ou présente peut entraîner des dysfonctionnements dans le cas de cellules tumorales humaines. Ainsi, lactivation du EGFR entraîne la croissance et la progression tumorale : langiogénèse, linvasion, le développement métastatique et linhibition de lapoptose. De ce fait, linhibition de lEGFR hautement exprimé par de nombreuses tumeurs solides est devenue une des stratégies contre le développement tumoral, mais aussi dans le cas de la section de moelle permettrait de diminuer la croissance de la cicatrice gliale.
Neuroprotection avec réduction de ldème
Aquaporine (AQP-4)
Les aquaporines sont une classe de protéines membranaires qui forment des « pores » perméables aux molécules d'eau dans les membranes biologiques. Elles sont exprimées sous la forme de tétramères, Trois AQP sont principalement exprimées dans le système nerveux central (SNC), les AQP1, AQP4 et AQP9. L'AQP4 est exprimée par les cellules épendymaires et les pieds astrocytaires en contact avec les vaisseaux cérébraux et la pie-mère. En condition physiologique, elle est impliquée dans la sécrétion du liquide céphalo-rachidien et l'homéostasie du milieu extra-cellulaire cérébral. En pathologie, elle joue un rôle dans la constitution de l'dème cérébral d'origine traumatique, ischémique ou néoplasique. LAQP4 semble avoir un rôle très important dans le développement de ldème après un traumatisme crânien, une lésion ou un accident vasculaire cérébral (figure 2).
|
|
Chez des rats ayant une lésion expérimentale de moelle épinière, lélectroacupuncture (EA) entraînerait une downregulation de lexpression de lAQP-4 (ou régulation négative caractérisée par une perte du nombre total des récepteurs de la surface cellulaire résultant soit d'une augmentation de leur dégradation, soit régulation négative de la transcription du gène, soit diminution de la stabilité des ARNm) par stimulation des points dazhui (14VG) et mingmen (4VG) du Vaisseau Gouverneur. Les résultats indiquent quun jour après la lésion de moelle, lexpression de lAQP-4 augmente et atteint un pic au troisième jour aussi bien dans le groupe contrôle que dans le groupe EA. Cependant, il est objectivé quà partir du 7ème jour, lexpression de lAQP-4 est diminuée de manière statistiquement significative (p<0,05 ou p<0,01) par rapport au groupe contrôle (mesurée à J7, J14 et J21) et saccompagne dune amélioration des fonctions neurologiques [[47],[48]]. Cela suggère que lEA au niveau des points du dumai peut inhiber ldème au niveau de la lésion en diminuant l'expression AQP-4, permettant de protéger les tissus sains résiduels ainsi que la reconstruction des tissus nerveux. Cet effet a été aussi démontré sur un modèle de rats avec ischémie cérébrale expérimentale sur lequel les auteurs réduisent ldème cérébral en puncturant shuigou (26VG) et baihui (20VG) pendant 30 min (EA à 3,85/6,25Hz, 0,8 1,0 mA) [[49]].
Radicaux libres : superoxide dismutase (SOD), malondialdehyde (MDA)
Dans
les 24 heures suivant une lésion expérimentale de moelle épinière chez le rat,
il est observé que le radical libre malondialdehyde (MDA), marqueur du stress
oxydatif, saccroît de manière progressive alors que le dismutase de superoxyde
(SOD), une des enzymes responsables des mécanismes de résistance des cellules
au stress oxydatif est diminué significativement. Lélectroacupuncture a
permis, deux à six heures après la lésion, de diminuer de manière
statistiquement significative (p<0,05) le taux de MDA et daugmenter
lactivité du SOD (p<0,01) dans le groupe acupuncture versus le groupe
témoin [[50]]. Cette action sur les
radicaux libres avait déjà été observée dans une étude chinoise en 2001 qui
confirmait laction de lacupuncture dans les gastrites stress-induites chez le
rat en inhibant les lésions dues aux radicaux libres tels le malondialdehyde et
en augmentant dans le plasma et la muqueuse gastrique l'activité de la
dismutase de superoxyde (SOD) [[51]]. Ainsi lélectroacupuncture
agirait encore sur ldème réactionnel du à la lésion de moelle épinière par
action sur la formation des radicaux libres.
Régénération axonale
Laminine
Les laminines désignent des glycoprotéines hétérotrimériques de la matrice extracellulaire, impliquées dans les phénomènes d'interactions cellulaires avec les intégrines, et constituants majeurs de la membrane basale sur laquelle reposent les cellules épithéliales, en dehors du collagène. Elles s'assemblent en un réseau de mailles fines dans la matrice extracellulaire et permettraient de créer des cellules souches embryonnaires humaines sans détruire l'embryon, préservant le caractère pluripotent de ces dernières. Ainsi, ces cellules ont la capacité de devenir n'importe quel tissu et offrent de ce fait le meilleur espoir de guérir nombre de maladies incurables et de réparer des organes détruits par un cancer ou un accident [[52]]. Les effets de lélectroacupuncture (EA) sur lexpression de la laminine ont été ainsi observés sur la régénération des fibres nerveuses chez un modèle de rat après lésion de moelle épinière au niveau de la 12ème vertèbre thoracique. On constate que dans le groupe des rats sous EA, lexpression de la laminine est augmentée significativement à la première semaine et demeure constamment élevée de la 2ème à la 4ème semaine par rapport aux trois autres groupes expérimentaux (groupe sham sans lésion + EA, groupe témoin avec lésion et sans EA, groupe hormone avec lésion et dexaméthasone). En bref, lEA pourrait promouvoir la production et la sécrétion de l'expression de la laminine et permettrait donc davoir un effet potentiel sur la capacité de régénération du système nerveux central [[53]].
Enzymes : acétylcholinestérase, succinate dehydrogenase, phosphatase acide
Jin et coll. ont montré que lélectroacupuncture augmenterait les taux des phosphatases acides aux 3ème (p<0,05) et 7ème jour (p<0,01) après lésion de moelle chez des chats au niveau de L1 par rapport au groupe contrôle, améliorant ainsi la régénération durant la période de récupération [[54]]. Par contre Wu et coll qui utilisent cette fois lacupuncture sur un modèle de rat avec lésion expérimentale de moelle épinière, montrent que le taux de phosphatase acide est diminué et ceux de lacétylcholinestérase (ACHE) et de la succinate déshydrogénase (SDH) sont augmentés [[55]]. Lacupuncture et lélectroacupuncture vont donc réguler ces enzymes et pourrait inhiber ou retarder la détérioration du neurone et permettre ainsi la régénération.
Augmentation du flux sanguin
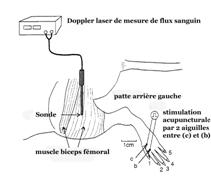
La régénération de la lésion de moelle épinière pourrait être aussi en rapport avec une accroissement du flux sanguin au niveau même de la lésion, limitant les dommages et permettant une meilleure récupération. Ce mécanisme physiopathologique a été mis en évidence dans la revue de littérature de Uchida et Hotta démontrant que chez les animaux anesthésiés (chez qui les facteurs émotionnels ont été supprimés) une stimulation acupuncturale entraîne un effet vasodilatateur dans différents organes avec amélioration du flux sanguin [[56]]. Ainsi par exemple, lélectroacupuncture réduit l'impédance (résistance) vasculaire dans les artères utérines [[57]]. Cela permet de réduire la pression artérielle et dinhiber l'activité vasoconstrictive du système sympathique tout en augmentant le flux sanguin ovarien [[58]]. Hotta et coll. suggèrent même que la stimulation cutanée périnéale engendre une augmentation de lactivité parasympathique avec libération dacétylcholine au niveau utérin [[59]]. Au niveau cérébral, une stimulation acupuncturale aussi bien manuelle quélectrique (20Hz ; 05ms de de 0,1 à 10mA) chez le rat augmente le flux sanguin cérébral cortical par limplication des fibres cholinergiques originaires du noyau basal magnocellulaire (NBM), équivalent chez lhomme du noyau basal de Meynert et induit de fortes augmentations du débit sanguin cortical sous-tendues par des mécanismes cholinergiques. Après section de moelle au niveau de la 1ère et 2ème vertèbre thoracique, la stimulation acupuncturale des pattes antérieures ou de la joue du rat permet une augmentation du flux sanguin cortico-cérébral persistant. Lélectroacupuncture interviendrait par la stimulation des fibres nerveuses afférentes du groupe III (Aδ) et du groupe IV (C), mais pas celles du groupe I (Aα) et du groupe II (A β) [[60]]. Nogushi et coll. retrouve les mêmes résultats par électrostimulation acupuncturale (1-20 Hz , durée 0,5ms ; 0,1-10mA) au niveau de la patte arrière du rat anesthésié (figure 4), à savoir stimulation des fibres afférentes III et IV agissant sur le flux sanguin au niveau musculaire. Dautre part, ils observent une réponse biphasique du flux sanguin au niveau du muscle biceps fémoral avec augmentation initiale (due à une activation systémique réflexe de la pression) puis une légère diminution (via une activation réflexe de lactivité nerveuse sympathique du muscle) avec une augmentation concomitante de la pression artérielle [[61]]. Les recherches ultérieures ont montré que lactivation antidromique des fibres afférentes du groupe IV (fibres C) produisent une action vasodilatatrice au niveau du muscle squelettique via libération du peptide lié au gène de la calcitonine (CGRP) [[62]], mais aussi au niveau des nerfs périphériques [[63]].
|
|
Figure 4. Daprès Nogushi, stimulation électroacupuncturale entre 2 aiguilles (b) et (c) et mesure du flux sanguin au niveau du biceps fémoral.
Action antalgique
Endorphines
Lélectroacupuncture à basse fréquence (2 Hz) déclenche la libération denképhaline, de bêta-endorphine et dendomorphine, alors quon a production de dynorphine à fréquence haute (100 Hz) Lintérêt de la libération des endorphines est bien sûr davoir un effet antalgique bien connu non négligeable [[64],[65]]. Cependant, dans les conditions physiopathologiques expérimentales de lésion aiguë de moelle, il savère que la production dun taux élevé de dynorphine entraîne un effet excito-toxique sur les neurones et la substance gliale avec hyperalgie via une action par les récepteurs au glutamate. Mais la libération de dynorphine par EA lors des lésions chroniques aura leffet inverse : analgésique et neuroprotecteur [[66]].
Action antistress
Cortisol
LEA à la fréquence de 8 Hz appliquée sur 60V, 40V et 3VG (voir figure 3), 15mn après une lésion expérimentale de moelle épinière au niveau de la 8ème vertèbre thoracique chez le rat objective dans le groupe EA une amélioration de leur fonction neurologique par rapport au groupe contrôle sans traitement. Cela saccompagne dune réduction de latrophie post-traumatique des lésions avec diminution de la perte des neurones de la corne antérieure.
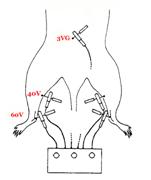
Figure 3. Localisation des points utilisés dans létude de Politis et coll. [67].
En outre, deux heures après la lésion, le dosage de cortisol plasmatique nest augmenté que de deux fois dans le groupe traité par électroacupuncture alors quil lest de trois fois dans le groupe non traité (p<0,05). Aucun des effets bénéfiques ne se retrouve 24 heures après la lésion de moelle épinière [[67]]. LEA serait donc utile dans les premiers heures de la lésion de moelle épinière en réduisant le stress par diminution du taux de cortisol [[68]].
Lavenir du traitement de la régénération axonale lors des séquelles de traumatismes vertébro-médullaires
Lavenir du traitement de la régénération axonale pourrait venir de lélectroacupuncture associée à la transplantation de cellules souches. Déjà, il avait été constaté que lutilisation de lEA sur le Vaisseau Gouverneur associé à la co-implantation de cellules de Schwann et de cellules souches nerveuses dans une moelle épinière lésée entraîne la différenciation en neurones-like au niveau de la lésion [69] grâce notamment à la production par le greffon de NT-3, dAMPc et de CGRP.
Neurotrophine 3 (NT-3), AMP cyclique, Calcitonin gene-related peptide (CGRP)
Le facteur neurotrophique NT-3 appartient aux neurotrophines dont font partie le nerve growth factor (NGF), le brain-derived neurotrophic factor (BDNF), la neurotrophine 4/5 (NT-4/5). Ce sont des facteurs essentiels pour la survie et la différenciation des neurones du système nerveux périphérique. Létude de Chen et coll. a objectivé que chez le rat après section de moelle épinière, lélectroacupuncture appliquée pendant 14 jours sur certains points du Vaisseau Gouverneur dumai (9VG zhiyang, 6VG jizhong, 2VG yaoshu et 1VG changqiang) entraîne une augmentation de 23% de la NT-3 dans le groupe EA associé au greffon co-implanté de cellules de Schwann et de cellules souches nerveuses par rapport au groupe greffon seul mais sans EA [[69]]. Il y a une différenciation du transplant des cellules souches nerveuses en neurones-like, avec régénération axonale comme lont montré aussi dautres travaux chinois [[70],[71]].
Ding et coll. [[72]] vont aller plus loin et objectivent que lélectroacupuncture (alternance de fréquence 60 Hz et 2Hz à une intensité de 1 mA pendant 20 mn, un jour sur deux pendant 7 semaines débutée au 7ème jour après la lésion expérimentale) sur les mêmes points du Vaisseau Gouverneur que létude de Chen (figure 5), associée à la transplantation cette fois-ci uniquement de cellules souches mésenchymateuses de moelle osseuse stimule la régénération axonale de la moelle lésée et montre une amélioration fonctionnelle chez le rat.
Ils ont utilisé des moelles épinières des rats complètement sectionnées transversalement au niveau de la 10ème vertèbre thoracique. Après 2 à 8 semaines de traitement associant EA et greffon de cellules souches mésenchymateuses de moelle osseuse, les auteurs constatent une augmentation statistiquement significative de neurotrophine 3 (p<0,01), dAMP cyclique (p<0,001) et une différenciation du greffon des cellules souches. Par ailleurs au bout de 8 semaines, dans le groupe greffon + EA, on retrouve une positivité également significative (p<0,01) à la sérotonine (5-HT) et à la CGRP (très puissant vasodilatateur général, agissant particulièrement au niveau de la circulation sanguine cérébrale) au niveau des fibres nerveuses lésionnelles et dans le tissu avoisinant la moelle épinière lésée en comparaison du groupe de transplantation seul ou du groupe EA seul. En outre, les tests comportementaux et la détection des potentiels évoqués de la moelle épinière montrent un rétablissement fonctionnel significatif dans le groupe EA + greffon versus les autres groupes.
En conclusion, lutilisation des transplants de cellules souches de moelle osseuse en association avec lélectroacupuncture agissent de manière synergique en modifiant lenvironnement hostile du site lésionnel et en promouvant la régénération axonale par accroissement des facteurs neurotrophiques et du niveau dAMPc et en inhibant la formation de la cicatrice gliale.
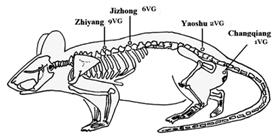
Figure 5. Les points du dumai utilisés par électroacupuncture : changqiang (1VG), yaoshu (2VG), jizhong (6VG), et zhiyang (9VG). Ces points correspondent aux points équivalents chez lhomme. Figure extraite de Ding et al. BMC Neuroscience 2009 10:35 doi:10.1186/1471-2202-10-35
Conclusion
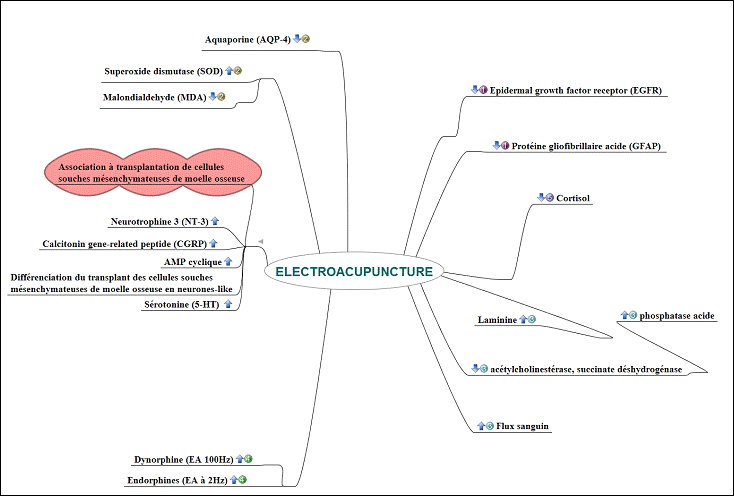
Figure 6. Les mécanismes physiopathologiques de lEA sur modèle expérimental de section de moelle chez le rat. Œ Réduction des cicatrices gliales ; Neuroprotection avec réduction de ldème ; Ž Régénération axonale ; Action antalgique ; Action antistress
|
|
Dr Jean-Marc Stéphan * jm.stephan@acupuncture-medicale.org Co-Directeur de la revue « Acupuncture & Moxibustion » Chargé d'enseignement à la faculté de médecine de Lille et Paris XI Médecin acupuncteur attaché au CH de Denain |