Jean-Marc Stéphan
A propos d’un cas clinique : intérêt de la
moxibustion, de l’acupuncture et de l’électroacupuncture
dans une oligoasthénozoospermie
Résumé : Introduction :
La baisse de la fertilité chez l’homme objectivée par de nombreuses études
observationnelles est l’une des problématiques dans le cadre de l’assistance
médicale à la procréation. L’objectif de ce travail est d’étudier l’intérêt de
la moxibustion associée à l’acupuncture et l’électroacupuncture
(EA) en cas d’oligoasthénozoospermie. Méthodes. Une étude d’un cas clinique
étudie un protocole de traitement suivant la différenciation des syndromes zheng. Ce cas
entre dans le cadre d’un Vide de yang du
Rein. Résultats. La moxibustion associée
à l’acupuncture améliore nettement la mobilité et le nombre de spermatozoïdes.
La discussion permet de tempérer ces résultats en fonction de la physiologie de
la spermatogenèse et des autres syndromes zheng, même si les nombreux
essais contrôlés randomisés et les études expérimentales montrent des résultats
positifs. Conclusion. En cas de Vide
de yang du Rein, une des causes d’oligoasthénozoospermie, il existe des preuves suffisantes
d’efficacité pour que la moxibustion associée à l’acupuncture et l’EA fasse
partie du panel de soins de santé. Mots-clés :
oligo-asthénozoospermie
– infertilité - acupuncture –
moxibustion – étude de cas – Vide de yang
de Rein.
Summary: Background:
The decline of fertility in
men objectified by many observational studies is one of the issues in the context
of assisted reproductive technology.
The objective of this work is to study the benefit of moxibustion combined with acupuncture and electroacupuncture
(EA) in case of oligo-asthenospermia.
Methods: A study of a clinical case study of a treatment according to syndrome differentiation
(bian zheng). This
case is part of an Kidney-yang deficiency.
Results. Moxibustion combined
with acupuncture significantly
improves mobility and sperm count. The discussion served
to temper these results based on the physiology of spermatogenesis and
other syndromes zheng, although
the many randomized controlled trials and experimental
studies showing positive results. Conclusion.
In case of a Kidney-yang deficiency, one of the causes of oligo-asthenozoospermia, there is sufficient
evidence of effectiveness
for that moxibustion combined
with acupuncture and EA is
part of the panel of health care. Keywords: oligo-asthenozoospermia
- Infertility - Acupuncture - Moxibustion - case study – Kidney-yang deficiency.
Introduction
Une étude fondée sur soixante et un articles a
objectivé que les concentrations de spermatozoïdes diminuait de 1% par an en
moyenne, de 113 millions/ml dans les années 1930 à 66 millions/ml dans les
années 1990 aux Etats-Unis [[1]].
Très discutée, cette première étude observationnelle fut réactualisée par Swan
et coll. en 1997. En intégrant d’autres études et en prenant en compte
l’origine géographique des sujets, ils confirmaient la baisse de la
concentration spermatique aussi bien en Amérique du Nord qu’en Europe (figure
1), mais non dans les pays non occidentaux [[2]]. En France, trois études menées grâce
aux donnée transmises par les Cecos (centres d’étude
et de conservation des œufs et du sperme humains) suggéraient également une
diminution du nombre de spermatozoïdes mais montraient une disparité régionale
avec par exemple un nombre de gamètes significativement plus élevé dans le Nord
et plus bas dans le Sud-ouest [[3]]. Il était aussi observé au Cecos de Tours une diminution du pourcentage de
spermatozoïdes mobiles passant de 64 à 49% entre 1976 et 2009 [[4]].
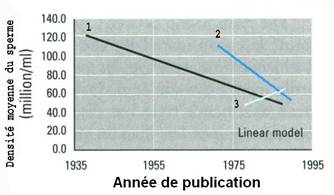
Figure 1. Densité
moyenne du sperme observée sur les études Nord-Américaines (1), Européennes et
australiennes (2) et non occidentaux (3) entre 1935 et 1995, d’après Swan [2].
Toutes ces observations
épidémiologiques posent de ce fait le postulat qu’en dehors des facteurs
géographiques, ethniques ou génétiques, il est possible que des facteurs
environnementaux interviennent sur la production de spermatozoïdes chez l’homme
[3]. De nombreux produits chimiques ont été incriminés
comme l’exposition professionnelle au pesticide dibromochloropropane
(DPCP) [[5]],
au plomb inorganique [[6]],
aux éthers de glycol [[7]],
au dibromure d’éthylène [[8]]
et autres pesticides [[9]],
au disulfide de carbone [[10]].
Le stress et les conditions de vie [[11],[12]]
interviennent également, ainsi que l’exposition à la chaleur [[13]].
D’autres arguments scientifiques plaident en faveur d’une exposition croissante
à différents polluants environnementaux, comme les phtalates
(Di-éthyl-hexyl-phtalate - DEHP ; DBP Dibutyl-phtalate ; BBP ; DEP etc.) et dérivés comme le
MEHP (métabolite du DEHP). Ceux-ci sont largement utilisés
dans la vie courante car produits en grandes quantités par les industries des plastiques.
On les trouve dans les adhésifs, les revêtements de sol en vinyle, les
détergents, les produits pharmaceutiques, les câbles électriques ou encore les
huiles lubrifiantes. Ils entraîneraient une baisse de la fertilité chez l’homme
par altération endocrinienne [[14],[15]].
D’autres composants fort répandus (bisphénol A, composés perfluorés,
retardateurs de flamme (composés polybromés
: PBDE- polybromodiphényléthers- etc.), parabènes) ont été analysés dans une
expertise collective de l’Inserm et sont considérés aussi comme perturbateurs
endocriniens. Un perturbateur endocrinien est une substance étrangère, produisant
des effets pathologiques par modification de la fonction hormonale au niveau de
l’appareil reproducteur en interférant avec la cascade de réactions intervenant
dans le métabolisme et le catabolisme des ligands naturels responsables du
maintien de l’homéostasie et de la régulation du développement de l’organisme [[16]].
Ainsi ont été mis en évidence chez l’homme le rôle de certaines molécules, comme
le DDT (dichlorodiphényltrichloroéthane), le PCB, les
phtalates DBP etc. qui agissent en agonistes ou
antagonistes des stéroïdes sexuels pouvant avoir une action avant ou après la
naissance [[17],[18],[19]].
Par ailleurs, il semble
également que l’âge de l’homme intervienne dans l’infertilité d'origine
masculine. En effet, un âge supérieur à 35 ans apparait comme un facteur majeur
de risque d'échec dans la conception d’un enfant [[20]],
tout comme un surpoids [[21]],
l’exposition au tabac durant la vie intra-utérine [[22],[23]]
ou la consommation d’alcool par la maman lors de la grossesse [[24]].
Bref, il s’avère que l’infertilité masculine peut résulter de causes
multifactorielles.
Méthodes
Présentation du cas clinique et protocole de
traitement
Mr Patrick S, âgé de 41 ans aux antécédents médicaux de syndrome dépressif,
consulte fin août 2011 pour un problème d’infertilité. Il est en surpoids avec
un indice de masse corporelle (IMC) à 27,7. Une insémination artificielle
intra-utérine avec sperme du conjoint (IAC) est programmée chez son épouse fin
octobre 2011.
Il me présente un spermogramme réalisé en janvier 2011 objectivant une oligoasthénozoospermie primaire puisque son nombre de spermatozoïdes
est à 5,36 millions/ml avec une mobilité à la première heure de 26%. Le second spermogramme
de contrôle idéalement réalisé à un mois d’intervalle n’a malheureusement pas
été réalisé. L’évaluation endocrinienne avec dosage sérique de la FSH et de la
testostérone est normale. Le bilan urologique ne relève ni varicocèle, ni
infection génitale, ni auto-immunisation antispermatozoïde
isolée. Il s’agit donc bien d’une oligoasthénozoospermie
idiopathique.
Lors de sa première séance, on retrouve parmi les signes cliniques des
lombalgies chroniques évaluées à l’échelle visuelle analogique à 2/10, une
fatigue, des selles molles, une baisse de la libido. La langue est pâle. Les
pouls sont xi (fin) et chen (profond).
Aucun traitement médical n’a été prescrit. Tout ceci évoque un Vide de yang du Rein. Le traitement acupunctural va comporter l’utilisation d’acupuncture avec
recherche du deqi sur les points 3R (taixi), 13R (qixue),
23V (shenshu) et de moxibustion à l’armoise sur les points 3VC (zhongji), 4VC (guanyuan) et zigong (« palais de l’enfant »), 4VG (mingmen)
et aussi sur le 23V. Une électroacupuncture (EA)
est appliquée aussi sur
le 29E (guilai)
à la fréquence de 10Hz (durée d’impulsion rectangulaire asymétrique de 0,5ms
d’un courant pulsé alternatif à moyenne nulle) par l’intermédiaire d’un
stimulateur électrique Agistim duo Sédatelec® à une intensité supportable par le patient.
Deux séances en moyenne de 25mn de stimulation acupuncturale
et d’EA par semaine sont réalisées (douze séances au total) dont 10 à 15mn de
moxibustion réalisées en début de séance, temps fonction de l’érythème et de la
sensation de cuisson à chaque point chauffé.
A la sixième séance, sont rajoutés en acupuncture 6Rte (sanyinjiao) et 36E (zusanli en moxibustion) qui en tonifiant la
Rate, renforcent le Sang, 20VG (baihui), 6MC (neiguan) et 7C (shenmen) qui calment le shen. En effet, se surajoutent des
signes de Vide de Sang du Cœur, avec une langue toujours pâle et toujours des
pouls xi (fin) et chen (profond).
Mais les signes cliniques évoluent avec une asthénie physique et mentale plus
intense. Apparaissent aussi quelques palpitations et acouphènes occasionnels,
une insomnie avec anxiété associée à un état de stress plus marqué.
Résultats
Le spermogramme réalisé lors de
l’insémination objective un nombre de spermatozoïdes de 8,01 millions/ml avec une mobilité 40%. Après
optimisation, la mobilité passe à 80% et on insémine 1,11 million de spermatozoïdes
mobiles. Malheureusement, la fécondation ne sera pas viable et le couple
s’orientera vers une fécondation in vitro. Néanmoins, ce cas clinique permet
d’observer une augmentation mais surtout une mobilité nettement accrue des
spermatozoïdes.
Discussion
Le spermogramme est le reflet de la spermatogenèse (celle-ci dure de 72 à 74 jours entre le moment de la
maturation de l'état de cellule germinale –spermatogonie- à celui de
spermatozoïde) qui va varier en fonction des tous les évènements intercurrents
durant cette période. On sait aussi qu’il existe de grandes variations d’un
spermogramme à l’autre chez un même patient, d’une semaine ou d’un mois à
l’autre. On peut découvrir ainsi un spermogramme normal une semaine puis une
oligozoospermie la semaine suivante, d’où la nécessité d’en réaliser plusieurs
dans le temps avant de conclure [[25]].
De ce fait, il est difficile de donner des valeurs seuils pour un spermogramme
insuffisant. Néanmoins pour avoir une bonne fertilité, il est retenu que le
nombre de spermatozoïdes doit être supérieur à 15 millions/ml avec un
pourcentage de mobilité totale supérieur à 40% [[26]].
L’oligoasthénozoospermie selon la Médecine Traditionnelle Chinoise
ne s’embarrasse pas de chiffres. Elle répond aux tableaux cliniques de la différenciation des syndromes zheng.
Les
syndromes zheng
L’oligoasthénozoospermie
se manifeste selon la différenciation
des syndromes zheng essentiellement par
les tableaux cliniques de : Vide de yang du Rein ; Vide du yin du Foie et du
Rein ; Vide de Rate ; syndromes Humidité-Chaleur du Réchauffeur
inférieur et/ou du Foie ; Glaires-Humidité [[27],[28],[29],[30]]. Néanmoins, peuvent se surajouter
en plus du tableau clinique principal d’autres atteintes, comme dans ce cas
clinique, le Vide de Sang du Cœur.
Les deux syndromes les plus fréquemment observés sont
d’une part le Vide de yang du Rein et d’autre part les syndromes Humidité-Chaleur.
Le Vide de yang du Rein
Il correspond
également au tableau de Vide du jing inné des Reins. L’Essence du Ciel antérieur est d’un
point de vue physiologique le jing qui peut être
désigné comme l’« Essence originelle séminale ». Ainsi, lors de l’acte sexuel,
la vie naît de la rencontre des jing de l’homme et de la femme. Cette Essence du Ciel
antérieur résulte donc de la dotation originelle et est transmise au fœtus.
Elle est stockée au niveau des Reins qui sont dépositaires et transmetteurs de
l’hérédité. Il s’agira donc de tonifier le Rein et aussi redonner de la vigueur
à la Rate. Selon Zheng [35], c’est le syndrome essentiel de l’infertilité masculine.
On pourra
remarquer par ailleurs que d’un point de vue physiopathologique, le jing étant en vide pourra entraîner un Vide
de qi de Rate qui recoupe le Vide de Sang. Le Cœur n'étant plus nourri en Sang,
sa communication entre le shen du Cœur et le jing des Reins sera
perturbée provoquant ainsi le Vide de Sang du Cœur, tel qu’on le retrouve dans
ce cas clinique.
Les syndromes d’Humidité-Chaleur du Réchauffeur
inférieur
Il faut les
comprendre comme Humidité-Chaleur de la Rate et/ou Humidité-Chaleur du Foie. Ce
sont des formes plénitudes. La langue n’est pas pâle et les pouls fins (xi) comme précédemment mais elle est
rouge avec un enduit jaune et gras et les pouls sont mous (ru) ou glissants (hua) et rapides (shuo). Ces syndromes sont
considérés comme responsables des syndromes inflammatoires, voire infectieux des
voies génitales.
Ce cas clinique semble donc objectiver qu’il est possible d’utiliser l’acupuncture
en cas d’infertilité masculine. Les essais contrôlés randomisés (ECR)
paraissent aussi le démontrer.
Les ECR
L’indication de traiter l’infertilité masculine est importante dans le
cadre de l’assistance médicale à la procréation. Ainsi Zhang et coll. ont
réalisé une petite étude clinique sur vingt-deux patients dont deux cycles de FIV-ISCI
en rapport avec une infertilité masculine avaient échoué. Les patients étaient
traités par acupuncture deux fois par semaine pendant huit semaines, séances
suivies d'un nouveau traitement ICSI. Par rapport au spermogramme de départ, on
observait que l'acupuncture avait significativement amélioré la motilité des
spermatozoïdes rapides (18,3% versus 11,0% ; p<0,01), ainsi que le ratio
des formes normales (21,1% vs 16,2% ; p<0,05). Le pourcentage de
fécondation après l'acupuncture (66,2%) était statistiquement (p<0,01) plus
élevé que celui avant le traitement (40,2%) [[31]].
Une étude de Trong Khanh
et Nguyen avait d’ailleurs montré en 2005 l’intérêt de l’acupuncture pour
améliorer le spermogramme en se basant sur sept études cliniques occidentales
et chinoises parues entre 1997 et 2005 [[32]].
Mais à part les ECR de Gunfinkel [[33]]
et de Pei [[34]], la plupart des autres essais
cliniques [30,[35],[36]] étaient hétérogènes, non randomisés, de
petits effectifs et qualité méthodologique non satisfaisante.
Deux autres essais parus en 2008 montraient également une amélioration de
l’oligoasthénozoospermie ou des anomalies du liquide
séminal. Petit bémol néanmoins car ces deux essais en langue chinoise, l’un
utilisant l’électroacupuncture et se comparant à la
phytothérapie chinoise [[37]]
et l’autre acupuncture et moxibustion associées à la phytothérapie chinoise [[38]]
étaient difficilement analysables.
Bien meilleur est l’ECR de Dieterle et coll. [[39]] en simple aveugle et contre placebo,
respectant les critères méthodologiques d’acupuncture STRICTA (Jadad=4) et qui s’est intéressé aux sévères oligoasthénozoospermies (concentration de spermatozoïdes
< 1 million/ml). Deux groupes, groupe acupuncture (n=28) et un groupe
placebo (n=29) ont bénéficié de deux séances de 45mn d’acupuncture par semaine
pendant six semaines. Les points utilisés sont ceux inspirés du protocole de
Pei [31] : 36E, 6Rte, 3R, 3F, 23V, 32V, 29E, 10Rte et
4VC (le 20VG est omis du protocole en raison de la difficulté technique de
fixer une aiguille placebo). On utilisait des aiguilles factices non
pénétrantes dans le groupe placebo, avec recherche du deqi dans le groupe acupuncture.
Les résultats montraient une augmentation statistiquement significative
(p=0,035) du pourcentage de motilité des spermatozoïdes par rapport au groupe
placebo, mais pas sur leur concentration.
Mécanismes d’action
Le mécanisme d’action de l’acupuncture résulterait, similairement à l’ovaire,
d’une augmentation du débit sanguin dans l’artère testiculaire (ou spermatique)
comme cela a été démontré dans un ECR par l’équipe turque de Cakmak [[40]].
Ainsi la stimulation électroacupuncturale à une
fréquence de 10hz au niveau du 29E (guilai) l’augmente de manière statistiquement significative
(p<0,005) par rapport à l’état basal. Les auteurs notent qu’il n’y a aucun
effet si la stimulation se fait à 2 Hz ou à la simple puncture.
Idem, il n’existe aucun effet lors de la stimulation du 25E de quelque façon
que ce soit.
L'hyperthermie scrotale (au-delà de 33°) est connue pour entraîner
certaines altérations de la spermatogénèse dont l’oligoasthéno-tératozoospermie voire l'azoospermie [[41],[42]].
Siterman et coll. démontrent que l’acupuncture
diminue la température scrotale et de ce fait améliore l’oligozoospermie. Ils
ont réalisé huit à dix traitements appliqués selon la différenciation des
syndromes : les points 6Rte, 4VC, 7P, 6R, 30E ont tous été stimulés
pendant 25mn en cas de Vide du Rein ou d’Humidité-Chaleur. Sont rajoutés 3R,
23V, 11R et 52V en cas de Vide de yang
du Rein exclusivement (attribué à un défaut de la spermatogenèse) ; ou
9Rte, 5F, 11GI, 28E et 41VB si Humidité-Chaleur (correspondant à une
inflammation de l’arbre génital). Des points secondaires peuvent aussi être
associés selon les zheng : 4GI, 36E, 10Rte, 7C, 20V, 6MC, 1VC,
2VC, 6VC, 4VG, 20VG, 20VB, 3F, 7R et 27VB. Pas plus de douze points par séance [[43]].
Siterman et coll. objectivent ainsi que l’acupuncture est d’autant plus efficace
que l’on traite les tableaux zheng d’Humidité-Chaleur. L’acupuncture agirait en stimulant
la réponse immunitaire de l’organisme.
L'action de l’EA sur l’hyperthermie scrotale est également analysée dans cette
récente étude de Gao. Une augmentation du nombre de spermatozoïdes épididymaires mobiles est observée qui s’expliquerait par
la prolifération des cellules germinales (spermatogonies) en rapport avec
l'amélioration des fonctions des cellules de Sertoli
[[44]]
(figure 2).
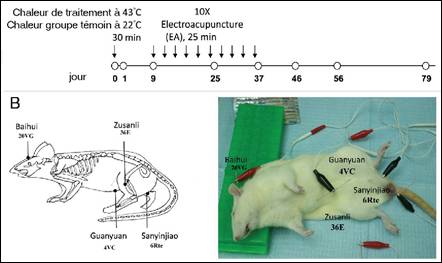
Figure
2. Schéma montrant le protocole de traitement d’EA
chez un rat Sprague-Dawley.
Ce modèle de rat a été mis en condition pendant 30 min par augmentation de la chaleur
du scrotum (43°C) dans le groupe traité ou température à 22°C dans le groupe
témoin. Au 9ème jour, l’EA a été effectuée tous les trois jours pour
un total de 10 séances (25 minutes chacun). Des échantillons de tissus ont été
prélevés au jour 0, 1, 9, 25, 37, 46, 56 et 79. L’EA a
été réalisée en six points d'acupuncture : baihui (20VG), guanyuan
(4VC), sanyinjiao
(6Rte; bilatéralement), zusanli (36E ; bilatéralement). Les points
d'acupuncture ont été stimulés électriquement avec une alternance de fréquences
de 3Hz et 9Hz pour éviter le phénomène de tolérance des tissus à la stimulation
(figure d’après [44])
Les traitements habituels de l’oligoasthénozoospermie
Nombreux sont les traitements non spécifiques proposés : androgénothérapie, antioestrogènes
(comme le clomifène, le tamoxifène), GnRH, kallicréines, bromocriptine,
pentoxifylline, gonadotrophines (HCG, HMG), carnitine, glutathion, arginine, zinc, sélénium, vitamines
A, C, E, indométacine, coenzyme Q10 etc.. Mais par manque d'études contrôlés randomisées
(ECR) en aveugle avec cross-over, aucun traitement n'a montré une efficacité
certaine pour être recommandé dans le cadre d'une infertilité idiopathique sans
anomalie biologique [[45],[46],[47],[48]].
Par ailleurs, excepté certaines molécules comme les vitamines, ces
thérapeutiques ne sont pas exemptes d’effets indésirables. De nombreuses autres
molécules sont encore à l’étude comme on peut le constater dans le
méta-registre d’essais cliniques contrôlés (mRCT)
concernant la transplantation de cellules souches, l’utilisation de metformine, de la lisinopril, des
inhibiteurs des aromatases, la supplémentation
en vitamine D ou en oméga 3 etc., mais aucune concernant l’efficacité de
l’acupuncture [[49]].
Conclusion
De nombreuses thérapeutiques, basées sur leur mode d'action in vitro ou des
essais cliniques ouverts non contrôlés, ont été proposées pour jouer un rôle
possible dans la gestion de l'infertilité masculine idiopathique.
Il existe aussi quelques essais contrôlés randomisés mais qui ne
parviennent pas à démontrer clairement un avantage décisif de leur efficacité.
D'autre part, certaines thérapies, tels que les androgènes et gonadotrophines,
peuvent nuire à la spermatogenèse ou entraîner des complications importantes. En
dehors de l’assistance médicale à la procréation, les options thérapeutiques conventionnelles
sont limitées et certains experts préconisent de continuer à prescrire ce genre
de médicaments. Cette politique de traitement peut être acceptable si le
patient et le médecin pensent avoir des attentes réalistes de résultat, tout en
préconisant les autres modalités thérapeutiques s’il n’y a pas d’amélioration
après une période de trois à six mois.
Pourtant, d’autres protocoles sont possibles, comme en témoigne encore cette
étude de cas iranienne de Bidouee et coll. [[50]].
En effet, ils montrent que quarante séances d’acupuncture utilisant l’approche
de Siterman [43] à raison de deux par semaine chez un homme de 31 ans
initialement en azoospermie a permis d’obtenir un spermogramme avec 18 millions
de spermatozoïdes/ml dont 10% ayant une bonne motilité et 60% de forme normale.
Et dans notre étude de traitement d’un Vide de yang du Rein selon la différenciation
des syndromes zheng et en appliquant les données en rapport
avec la recherche physiologique des mécanismes d’action (EA à 10Hz), l’oligoasthénozoospermie peut être également améliorée par la
moxibustion associée à l’acupuncture et l’EA.
Quoi qu’il en soit et compte tenu du fait que l’acupuncture est une
thérapeutique sûre et sans effets secondaires significatifs, on se doit donc de
la considérer comme ayant toute sa place dans le panel de soins de santé.
|
|
Dr Jean-Marc Stéphan * jean-marc.stephan@univ-lille2.fr Co-directeur de la revue « Acupuncture & Moxibustion » Co-coordinateur du DIU acupuncture obstétricale Lille 2 Chargé d'enseignement à la faculté de médecine Paris Sud XI et Rouen Conflit d’intérêts : aucun |
Références
