Résumé : De nombreux paramètres interviennent dans l’analgésie électroacupuncturale : la fréquence, l’intensité, la durée d’impulsion, le temps d’intervention. On devra tenir compte à la fois du développement de la tolérance souvent lié à l’octapeptide cholécystokinine (CCK-8) ou à la nociceptine, mais aussi de la variabilité individuelle à l’électroacupuncture (EA). Chez le rat, l’effet optimum dans les algies par action de l’EA sera obtenu globalement en stimulant par alternance en basse (2 Hz) et haute fréquence (100 Hz) ou simplement à la fréquence de 15 Hz, de façon à ce que les quatre sortes de peptides opioïdes (endorphines, enképhalines, endomorphines et dynorphine) soient libérées simultanément. Il s’agira également de ne pas dépasser les 30 minutes de stimulation sous peine de déclencher le système anti-opioïde. Mots-clés : électroacupuncture – fréquences – peptides opioïdes – tolérance – octapeptide cholécystokinine.
Summary: Many parameters involved in electroacupunctural analgesia: frequencies, intensity, pulse width, intervention time. It should take into account both the development of tolerance often linked to the cholecystokinin octapeptide (CCK-8) or the nociceptine, but also of individual variability in the electroacupuncture (EA). In rat, the optimum effect in pain by action of the EA will be achieved globally by alternately stimulating low (2 Hz) and high frequency (100 Hz) or just 15 Hz, so that the four types of opioid peptides (endorphins, enkephalins, endomorphins and dynorphin) are released simultaneously. It will also not exceed 30 minutes on pain stimulation to trigger the antiopioids. Keywords: electroacupuncture – frequencies – opioid peptides – tolerance – cholecystokinin octapeptide.

Les derniers travaux de physiologie et d’imagerie concernant l’électroacupuncture dans les algies ont permis de se faire une idée plus précise de la nature de ses mécanismes neurophysiologiques. On connaît l’implication de la libération des neuropeptides opioïdes, l’action inhibitrice des récepteurs ionotropiques glutaminiques et la modulation de la douleur par le système inhibiteur descendant sérotoninergique et catécholaminergique [ [1] ]. Pour bien maîtriser cette technique, il convient alors de bien connaître les différents paramètres électrophysiologiques.
Caractéristiques paramétriques de l’électroacupuncture
La stimulation électrique des points d’acupuncture s’appelle l’électroacupuncture (EA). On utilise des appareils permettant de délivrer soit des courants pulsés alternatifs à moyenne nulle (constitués d’impulsions soit positives, soit négatives, mais qui ne changent pas de polarité cycliquement), soit des courants pulsés unidirectionnels (constitués d’impulsions uniquement positives). Les appareils doivent être manufacturés de manière réglementaire, car dans une étude, il s’est avéré qu’au moins deux des paramètres mesurés sur trois ne se trouvaient pas dans la marge de sécurité des valeurs données par le constructeur, ce qui peut être inquiétant pour le patient [ [2] ].
Le courant est caractérisé par :
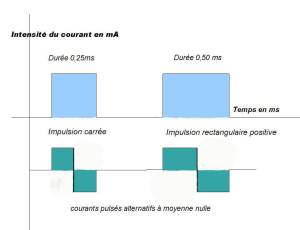
– la forme de son impulsion : carrée ou rectangulaire,
– la durée de cette impulsion : variable de 0,1 ms à 5 ms, (voir figure 1)
– l’intensité efficace : variable de 0,1 à 6 mA
– la fréquence : variable de 2 à 100 Hz
Variables électrophysiologiques de l’électroacupuncture
Fréquence
De nombreux paramètres influencent l’action de l’électroacupuncture, en particulier l’utilisation de différentes fréquences, qu’elles soient basses (2 à 4 Hz) ou élevées (100 à 200 Hz). En effet, des études révèlent par exemple que l’EA à fréquence basse entraîne une libération d’enképhaline, de bêta-endorphine et d’endomorphine, alors qu’à fréquence haute, il y a libération d’un autre type d’endorphine : la dynorphine [3-9].
Dès 1992, Chen et Han montrent que l’analgésie produite par l’EA (durée d’impulsion de forme carrée de 0,3 ms) est médiée par trois types de récepteurs opioïdes [ [10] , [11] ]. Ainsi, l’EA à 2 Hz active les récepteurs μ et δ ; celle à 100 Hz, les récepteurs κ. Mais mieux, l’EA à 15 Hz produit une activation des trois sortes de récepteurs chez le rat [9 ].
En 1996, Guo et coll. [ [12] , [13] ] démontrent que l’électroacupuncture à 2 Hz et à 100 Hz (durée d’impulsion de forme rectangulaire de 0,3 ms) a un effet sur le niveau de l’expression des gènes encodant trois neuropeptides du cerveau chez le rat. Ainsi la stimulation à 2 Hz augmente l’expression c-fos au niveau du noyau arqué de l’hypothalamus avec augmentation de l’expression de l’ARN messager pour un précurseur de l’endorphine, le préproenképhaline (PPE). Au niveau, de la formation réticulaire rostro-médiale (noyau gigantocellulaire, paragigantocellullaire, formation réticulaire latérale), la stimulation à la fréquence de 100 Hz augmente sélectivement l’expression de l’ARN messager pour le préprodynorphine (PPD). Les auteurs montrent aussi que les protéines proto-oncogènes c-fos et/ou c-jun jouent davantage un rôle dans la transcription des gênes des opioïdes PPD que dans celles de PPE et des POMC [12-14].
L’électroacupuncture (ES36, RA6) à la fréquence de 2 Hz agit aussi dans les algies en diminuant la réponse à l’inflammation locale par l’intermédiaire de la modulation de l’expression des récepteurs ionotropes au glutamate et en particulier le récepteur au N-méthyl-D-aspartate (NMDA) dans la corne dorsale de la moelle épinière [ [15] , [16] ]. Malheureusement, dans ces études, du fait du manque de groupe contrôle sham, les résultats ne peuvent attribués complètement à l’action de l’électroacupuncture seule.
Selon la fréquence de la stimulation, l’EA chez les rats diminue la douleur neuropathique induite par ligature d’un nerf rachidien. Il a ainsi été observé que l’EA à basse fréquence (2 Hz) sur le ES36 et RA6 produisait davantage d’effets antinociceptifs et prolongés dans le temps sur l’allodynie (douleur produite par un stimulus non nociceptif) et l’hyperalgie nociceptive thermique que l’EA à haute fréquence (100 Hz) sur un modèle de rats. Les récepteurs opioïdes et les récepteurs NMDA participent à ces effets antalgiques de longue durée [ [17] , [18] ].
La combinaison des fréquences alternées et asynchrones permet d’améliorer l’action de l’EA. Ainsi deux modes d’EA ont été étudiés : le mode 2+100 Hz, mode où la stimulation de 2 Hz est appliquée à la patte arrière gauche du rat en même temps que 100 Hz à la patte arrière droite ; le mode 2/100Hz où la stimulation 2 Hz est alternée toutes les 3 secondes avec celle de 100 Hz. Il s’avère que le mode 2/100 Hz est 40% plus antalgique que le mode 2+100 Hz (p<0,01). L’injection intrathécale d’un antagoniste des récepteurs opioïdes mu a bloqué l’effet anti-nociceptif du mode 2/100 Hz, mais pas celui de l’EA 2+100 Hz, tandis que l’injection d’un antagoniste des récepteurs opioïdes kappa a bloqué les deux modes d’EA. En conclusion, l’EA 2/100 Hz augmente la libération à la fois des endomorphines-2 et de la dynorphine. L’EA 2+100 Hz libère seulement la dynorphine [ [19] ].
Lao et coll. ont créé un modèle de douleur inflammatoire par injection d’adjuvant de Freund (émulsion d’eau et d’huile quelquefois additionnée de bactéries, bacilles de Koch inoffensifs) sur la patte arrière des rats. Ils ont évalué ensuite les paramètres de l’analgésie par EA (fréquence, intensité, durée du traitement, et durée d’impulsion). Ils précisent ainsi que l’analgésie par EA à 10 Hz est plus efficace que celle à 100 Hz pour les traitements antalgiques à long terme. L’EA à 100 Hz est à privilégier pour les effets rapides à court terme [ [20] ].
Plus récemment, on constate que l’EA à 100Hz (intensité 0,5 mA, onde biphasique carrée asymétrique) entraîne un effet antinociceptif qui est variable en fonction du point d’acupuncture stimulé et sans doute en fonction de l’algie. Ainsi sur un modèle de douleur orofaciale induite par chaleur sur la branche maxillaire du nerf trigéminal chez le rat, l’EA à 100 Hz appliquée sur le ES36 pendant 20 minutes sera analgésique, mais pas l’EA à 5 Hz et 30 Hz. Pas d’action analgésique non plus de l’EA à 5, 30 ou 100 Hz appliquée sur le GI4. L’effet antinociceptif de l’électroacupuncture est médiée par l’activation des opioïdes endogènes (la dynorphine dans ce cas), elle même activée par le monoxyde d’azote (NO) et dépend donc de la localisation de la douleur, du choix du point et de la fréquence de stimulation [ [21] ].
Intensité
Huang et coll. vont montrer chez la souris que l’analgésie induite par EA varie en fonction de la fréquence, mais aussi de l’intensité. Ainsi l’analgésie ne sera produite chez la souris (évaluée par le test de tail-flick qui mesure la latence entre l’application de la stimulation thermique et le premier mouvement échappatoire de la queue) qu’à partir d’une intensité de 0,5 mA et sera à son optimum pour 2 Hz et 100 Hz (durée d’impulsion carrée commune respectivement de 0,6 ms et 0,2 ms) par rapport au groupe témoin [ [22]].
Une autre étude montre l’importance de l’intensité de l’EA. Les récepteurs opioïdes du noyau thalamique submédian sont impliqués dans l’analgésie de l’EA à haute intensité et basse fréquence (5 mA, 5 Hz par série d’impulsions carrées constantes de 0,3ms) alors qu’à haute fréquence et faible intensité (50 Hz, 0,5mA), c’est le noyau antérieur prétectal qui intervient, tout en sachant que ces deux structures sont habituellement impliquées dans la modulation du système inhibiteur descendant [ [23] ].
Lao et coll. constatent que les fréquences 10 et 100 Hz à une intensité de courant de 3 mA produisent la plus grande analgésie. Une intensité moindre à 1 ou 2 mA est moins efficace [20 ].
Durée de l’impulsion
La durée d’impulsion électrique correspond à celle d’un stimulus constant. Ainsi, dans une période de temps donnée et à une fréquence de 10 Hz, une impulsion d’une durée de 2 ms fournit vingt fois plus de stimuli électriques qu’une impulsion de 0,1 ms. Romita et coll. ont évalué la durée d’impulsion électrique de l’EA (4 Hz) nécessaire pour une analgésie efficace sur un modèle de nociception-chaleur chez le rat. Ils constatent qu’une durée d’impulsion (de forme carrée monophasique) de 0,2 ms est satisfaisante en terme de persistance et d’efficacité de la réponse antinociceptive à court terme mais celle-ci s’atténue sur le long terme par rapport aux réponses produites avec une EA à une impulsion de 2 ms ou 5 ms. Cela s’explique par le fait que l’activation des fibres C nécessite généralement une durée d’impulsion au minimum de 0,5 ms, voire égale ou supérieure à 1 ms [ [24] ]. De ce fait, dans leur étude suivante sur l’action antinociceptive de l’EA , ils ont choisi une EA à 4 Hz avec une impulsion de forme carrée de 2 ms appliquée pendant 20 mn [ [25] ].
L’étude paramétrique de Lao et coll. analyse toutes les variables électrophysiologiques de l’EA : fréquence, intensité, durée d’intervention, spécificité du point d’acupuncture et surtout une des seules à étudier précisément la durée de l’impulsion. La durée d’impulsion a été aussi étudiée avec un stimulateur électrique (A300 pulsemaster®, World Precision Instruments) (figure 2). Les auteurs ont observé dans ce travail qu’avec une intensité de 1 mA, une EA de 10 Hz/2 ms produit un effet antalgique à court terme similaire à celle produite à une intensité de 3 mA et une fréquence de 100 Hz avec une impulsion de 0,1ms. Ils objectivent aussi que les effets prolongés observés à 10 Hz/0,1ms disparaissent quand la durée d’impulsion passe à 2 ms. Il apparaît ainsi que l’accroissement de la durée de l’impulsion a le même effet que l’accroissement de la fréquence électrique ou que l’augmentation moyenne de la durée de stimulation [20 ].
 Figure 2. Le stimulateur A300 pulsemaster. |
Durée d’intervention
Lao et coll. ont montré aussi qu’une EA délivrée pendant 20 minutes est plus adaptée dans l’analgésie qu’un traitement court (10 mn) ou long (30 mn). Le VB30 (huantiao) est plus efficace que le point 5TR (waiguan) ou qu’un point placebo ou même que le point VB30 opposé à l’inflammation algique. D’où spécificité de l’action du point d’acupuncture [20 ].
Sur un modèle de douleur inflammatoire induite chez le rat par l’adjuvant de Freund, l’EA appliquée avec un Han’s Acupoint Nerve Stimulator (HANS), 100 Hz, 0,5-1,0-1,5 mA, 10 min pour chaque intensité, impulsion carrée de 0,2ms en une seule session sur 36ES et 6RP augmente de façon statistiquement significative le seuil de retrait dans les algies mécaniques mais pas dans les algies thermiques (plaque chaude à 52 +/- 0,2°C). La répétition des sessions deux fois par semaine pendant 4 semaines montre une diminution sensible de l’hyperalgésie mécanique à la troisième et quatrième semaine, sans incidence sur l’hyperalgésie thermique. L’effet analgésique est inhibé par la naloxone, objectivant encore l’intervention du système opioïde [ [26] ].
Taguchi [ [27] ] a induit une hyperalgie en injectant de la carragénine (inducteur inflammatoire extrait d’algues rouges) dans le tissu sous-cutané de la patte postérieure de rats afin d’étudier l’effet analgésique de différentes fréquences, d’intensités et de durée de l’EA. Les seuils nociceptifs ont été évalués par un test de Randall-Selitto qui permet de les déterminer en exerçant une pression mesurable. L’EA (durée d’impulsion de forme carrée biphasique de 0,1 ms) sur ES36 a été appliquée à 3, 15 ou 100 Hz pendant 1, 15, ou 60 minutes. L’EA est commencée trois heures après l’injection de carragénine. L’EA à 3 Hz (au bout de 15mn et à 60 minutes) a induit une analgésie statistiquement significative qui a persisté pendant 24 heures après l’injection. Par contre, pas d’analgésie avec l’EA à 15 ou 100 Hz dans le cadre des algies provoquées par la carragénine chez le rat à la différence de celle provoquée par l’adjuvant de Freud [20 ]. Importance donc de la fréquence, de la durée dans l’induction de l’analgésie. Le tableau I récapitule les principaux résultats de ces travaux.
Tableau I. Récapitulatif des principaux travaux et leurs conclusions.
| Auteur (année) | Caractéristiques de l’électroacupuncture | Localisation cérébrale : visualisation par expression c-fos / ac anti-récepteurs stimulés / imagerie fonctionnelle | Conclusions |
| Chen et Han (1992)[10 ,11 ] | (durée d’impulsion de forme carrée de 0,3 ms) 2 Hz de 1mA à 3mA par palier de 10mn ES36 et RA6 chez le rat | récepteurs μ et δ | Libération de : Endorphines Met-enképhaline endomorphine [9 ] |
| 100 Hz de 1mA à 3mA par palier de 10 mn ES36 et RA6 chez le rat | récepteurs κ | Libération de : dynorphine | |
| 2 Hz en alternance avec 15 Hz toutes les 2,5s de1mA à 3mA 30mn ES36 et RA6 chez le rat | récepteurs μ et δ et κ | Libération de : Endorphines Met-enképhaline dynorphine | |
| Guo (1996) [12 ,13] | (durée d’impulsion de forme rectangulaire de 0,3 ms) 2 Hz au ES36 (zusanli) et RA6 (sanyinjiao) 1mA, 2mA, 3mA chez le rat (10mn à chaque intensité) | Télencéphale (amygdale médiale et corticale, noyau supraoptique-noyau paraventriculaire, noyau médial optique) Hypothalamus (noyau arqué, noyau paraventriculaire, périventriculaire, dorsomédial, ventromédial, noyau supramammillaire) Mésencéphale substance grise périaqueducale Tronc cérébral (ruban de Reil latéral-lemniscus latéral ventral,noyau solitaire, noyau parabrachial latéral) | Libération de : Préproenképhaline |
| 100 Hz : 36ES (zusanli) et 6RA (sanyinjiao) 1mA, 2mA, 3mA chez le rat (10mn à chaque intensité) | Télencéphale (Amygdale médiale et corticale, habenula –pédoncule antérieur de l’épiphyse, noyau supraoptique-noyau paraventriculaire, noyau medial optique) Diencéphale (Noyau thalamique paraventriculaire) Mésencéphale substance grise périaqueducale Tronc cérébral ( tubercules quadrijumeaux – inferior colliculus, noyau gigantocellulaire, paragigantocellullaire, formation réticulaire latérale) | Libération de : préprodynorphine | |
| Lao (2004)[20 ] | (durée d’impulsion = 0,1 ; 1 et 2 ms) 10 Hz, 100 Hz pendant 10,20,30mn 1 à 3 mA Algie induite par adjuvant de Freund chez rat VB30, TR5, points placebos | Expression C-fos : 10 et 100 Hz : suppression couches superficielles de Rexed (I / II) de la corne dorsale de la moelle épinière (afférences nociceptives, lame I, ou couche marginale, reçoit des fibres Aδ ; lame II, ou couche gélatineuse : fibres C.) activation couches superficielles de Rexed (III / IV) (terminaisons des fibres Aα et Aβ) | – Analgésie de l’EA à 10 ou 100 Hz (3 mA) de 20 minutes plus efficace que 10 mn ou 30 mn : importance de la durée -10 Hz/0,1ms/3 mA plus bénéfique que 100 Hz sur l’algie inflammatoire à long terme – importance de l’intensité : 10 ou 100 Hz/0,1ms/ 3 mA plus efficace qu’à 1mA – spécificité d’action du point – durée d’impulsion = même effet que l’augmentation de la fréquence |
| Zhu (2004)[23 ] | 5 Hz (ES36) 5 mA, 15 mn | Noyau thalamique submédian (fibres afférentes de petit diamètre A-δ et C) | Efficacité similaire de la haute ou basse intensité, mais différents effets |
| 50 Hz (ES36)0,5 mA 15mn | Noyau antérieur prétectal (fibres afférentes de gros diamètre A-β) | ||
| Wang (2005)[19 ] | 2+100 Hz2 Hz la patte arrière gauche du rat en même temps que 100 Hz à la patte arrière droite | Libération dynorphine | Efficacité plus grande de l’EA 2/100 Hz |
| 2/100 Hz alternance 2 Hz toutes les 3 secondes avec 100 Hz | Libération dynorphine + endomorphine-2 | ||
| Taguchi (2007)[ 27 ] | impulsion biphasique carrée de 0,1ms 3, 15, or 100Hz pendant 1mn, 15 mn,60mn intensité : 3mA (3Hz) ; 1,5mA (15 et 100Hz) ES36 | Analgésie produite dès 15mn à la fréquence de 3 Hz. Importance de la fréquence et de la durée. | |
| Algie induite par carragénine chez rats | |||
| Almeida(2008)[21 ] | intensité 0,5 mA, onde biphasique carrée asymétrique 5, 30, or 100Hz 20 mn ES36 et GI4 | Libération dynorphine (médiée par NO) induit par EA à 100Hz sur ES36 Pas d’action de l’EA à 5 et 30 Hz sur ES36 Pas d’action de l’EA à 5 et 30 et 100 Hz sur GI4 | Importance de la spécificité du point d’acupuncture en fonction de l’algie Importance de la fréquence de l’EA (100Hz) |
| Algie orofaciale induite par chaleur chez le rat |
La tolérance
En 1981, la tolérance à l’analgésie acupuncturale a été décrite en observant que la durée de l’analgésie était corrélée à la durée de l’administration de l’EA. Appliquée au rat pendant 30 mn, l’EA augmente son seuil de tolérance à la douleur de 89%. Lorsque la stimulation est répétée plus de six sessions consécutives avec des intervalles de repos de 30 mn, une sensibilité décroissante (tolérance) va se développer avec un retour à l’état basal [ [28] ]. Cette tolérance est le résultat d’une désensibilisation des récepteurs opioïdes (down regulation), mais aussi à la libération de l’octapeptide cholecystokinine (CCK-8) [ [29] ]. Han et coll. vont même annuler le phénomène de tolérance par une injection intraventriculaire d’antisérum de CCK-8 au groupe de rats ayant bénéficié d’EA en continu pendant 8h [ [30] ]. Il a été ainsi mis en évidence chez le rat que CCK-8 réalise un rétro-contrôle négatif de l’analgésie électroacupuncturale au delà de 30 mn de stimulation, et en fonction des fréquences. Le pourcentage d’augmentation en CCK-8 est obtenu à la fin de la première heure (+36%), atteint un niveau maximal (+60%) à la fin de la 2ème heure, fluctue entre 3 et 5 h puis se maintient à haut niveau (+54%) à la fin de la 6ème heure. Ce sont les fréquences hautes de 15 Hz ou 100 Hz qui libèrent davantage de CCK-8 [ [31] , [32] ]. Il faut noter que l’électroacupuncture à 100 Hz (0,2-0,3 mA, impulsion de 0,3ms, 30 mn) du 36ES limite la satiété chez les rats Sprague-Dawley LETO en rapport avec la CCK agissant sur le récepteur CCK-1 [ [33] ].
La CCK-8 n’est pas le seul anti-opioïde intervenant dans la tolérance de l’électroacupuncture. Tian et coll. montrent que l’orphanine FQ (ou nociceptine) participe également à la modulation de l’analgésie induite par l’EA à 100 Hz [ [34] ] et que la tolérance produite par EA (100Hz, 3mA, impulsion carrée de 0,3 ms sur le 36ES et 6RP) sera réversible par injection intracérébro-ventriculaire d’anticorps anti-orphanine FQ (OFQ-ab) [ [35] ].
Différences individuelles et potentialisation de l’EA
Il existe des différences individuelles à l’électroacupuncture. En effet, de nombreux auteurs ont distingué des répondeurs et non répondeurs sensibles à l’EA. Le mécanisme impliqué est double : un bas niveau de libération de peptides opioïdes dans le SNC et un haut niveau de libération de CCK-8 dans la substance grise périaqueducale [ [36] , [37] ].
Prolonger l’effet analgésique de l’électroacupuncture est possible en la combinant avec la dizocilpine (MK-801), antagoniste non compétitif du récepteur NMDA du glutamate. Sur un modèle d’hyperalgie provoquée par injection de Freund dans le coussinet plantaire de la patte de rat, l’EA (30VB) à la fréquence de 10 et 100 Hz (A300 pulsemaster® : impulsion de 0,1ms à 3 mA) associée au MK-801 en sous-dose efficace est statistiquement plus antalgique (p<0,05) que le MK-801 seul [ [38] ]. On a le même effet synergique avec l’indométacine [ [39] ] ou avec de faibles doses de celecoxib [ [40] ].
Que retenir ? Les points essentiels
Fréquence : dans les algies, il faut stimuler à la fois en basse (2 Hz) et haute fréquence (100 Hz), chacune durant 3 secondes en alternance, de sorte que les quatre sortes de peptides opioïdes (enképhalines, endorphine, endomorphine et dynorphines) soient libérées simultanément, produisant une interaction synergique. Une possibilité équivalente est de stimuler dans la fréquence 15 Hz qui entraîne la même action sur les neuropeptides. A noter que les fréquences hautes (100 Hz) sont à privilégier si on veut une action immédiate à court terme, alors que les basses (2 Hz) produisent une action antalgique plus durable.
Durée de l’impulsion : en pratique, il n’est pas possible d’agir sur cette variable qui est en général fixée par le constructeur à 0,5 ms, valeur optimum pour les différentes fréquences.
Intensité de la stimulation : plus l’intensité sera forte et plus l’antalgie sera meilleure. Demander donc au patient d’endurer la limite du supportable, tout en sachant que la plupart des appareils ne délivrent généralement que 4 à 5 mA sur 1000 Ohm d’intensité efficace maximale.
Durée d’intervention : pas plus de 30 mn. Au-delà, le phénomène de tolérance se déclenche par activation du système anti-opioïde.
Spécificité du point d’acupuncture : bien choisir le point et la fréquence de stimulation en fonction de l’algie.
Implications pratiques dans les algies
Des essais contrôlés randomisés (ECR) ont mis en pratique les données expérimentales. Pour exemple, un ECR en double aveugle contre placebo de haute qualité méthodologique (jadad à 5) concernant les douleurs post-thoracotomiques chez 27 patients opérés suite à un carcinome pulmonaire a montré que dans le groupe EA, il y avait au deuxième jour une diminution de l’usage de la morphine statistiquement significative par rapport au groupe placebo (7,5 +/- 5 mg versus 15,6 +/- 12 mg ; p < 0,05). Les points de l’EA utilisés étaient : GI4, VB34, VB36 et TR5, points reconnus pour leur influence sur les algies thoraciques. L’EA était commencée immédiatement au retour de la salle d’opération. Le patient recevait deux sessions de 30 mn par jour d’EA à la fréquence de 60 Hz et cela pendant un total de 7 jours. La fréquence 60 Hz a été choisie comme fréquence moyenne (comme le 15 Hz) entraînant une action sur tous les récepteurs opioïdes. Cependant, les auteurs recommandaient de réaliser d’autres études en utilisant différentes fréquences [[41] ].
En conclusion, l’électroacupuncture doit faire partie de l’arsenal de tout acupuncteur dans les algies de quelque nature que ce soit, à condition d’en bien maîtriser tous les paramètres. La découverte de l’action de l’EA sur la libération des neuropeptides opioïdes a même engendré des études cliniques dans les addictions aux morphiniques. Ainsi, Zhang et coll. [ [42] ] ont permis une détoxication de 121 héroïnomanes au bout de 14 jours suite à une électroacupuncture pluri-quotidienne alternées de 2 et 100 Hz utilisant la méthode d’EA issus des travaux de Han [3 ,6 ,7 ]. Plus récemment, Mu et coll. objectivent une amélioration des effets de sevrage dans l’addiction à l’héroïne grâce à l’EA de points jiaji (EX-B2) [ [43] ]. Malheureusement, ces deux ECR montrant une efficacité, résultent d’études en langue chinoise dont l’évaluation méthodologique reste difficile à apprécier [ [44] , [45] ].

Références
[1] . Stéphan JM. Mécanismes neurophysiologiques de l’électroacupuncture dans les algies. Acupuncture & Moxibustion. 2008;7(2):127-137.
[2] . Lytle CD, Thomas BM, Gordon EA, Krauthamer V. Electrostimulators for acupuncture: safety issues. J Altern Complement Med. 2000;6(1):37-44.
[3] . Han JS, Sun SL. Differential release of enkephalinand dynorphin by low and high-frequency electroacupuncture in the central nervous system. Acupunctur Sci Int J. 1990;1:19-27.
[4] . Ulett GA, Han S, Han JS. Electroacupuncture : mechanisms and clinical application. Biol Psychiatry. 1998 Jul 15;44(2):129-138.
[5] . Ulett GA, Han J, Han S. Traditional and evidence-based acupuncture: history, mechanisms, and present status. South Med J.1998;91(12):1115-20.
[6] . Han Z, Jiang YH, Wan Y, Wang Y, Chang JK, Han JS. Endomorphin-1 mediates 2 Hz but not 100 Hz electroacupuncture analgesia in the rat. Neurosci Lett. 1999;274(2):75-8.
[7] . Wu LZ, Cui CL, Tian JB, Ji D, Han JS. Suppression of morphine withdrawal by electroacupuncture in rats : dynorphin and kappa-opioid receptor implicated. Brain Res. 1999;851(1-2):290-6.
[8] . Huang C, Wang Y, Chang JK, Han JS. Endomorphin and mu-opioid receptors in mouse brain mediate the analgesic effect induced by 2 Hz but not 100 Hz electroacupuncture stimulation. Neurosci Lett. 2000;294(3):159-62.
[9] . Han JS. Acupuncture and endorphins. Neurosci Lett. 2004;361(1-3):258-61.
[10] . Chen XH, Han JS. Analgesia induced by electroacupuncture of different frequencies is mediated by different types of opioid receptors: another cross-tolerance study. Behav Brain Res. 1992;47(2):143-9.
[11] . Chen XH, Han JS. All three types of opioid receptors in the spinal cord are important for 2/15 Hz electroacupuncture analgesia. Eur J Pharmacol. 1992;211(2):203-10.
[12] . Guo HF, Tian J, Wang X, Fang Y, Hou Y, Han J. Brain substrates activated by electroacupuncture of different frequencies (I): Comparative study on the expression of oncogene c-fos and genes coding for three opioid peptides. Brain Res Mol Brain Res. 1996;43(1-2):157-66.
[13] . Guo HF, Tian J, Wang X, Fang Y, Hou Y, Han J. Brain substrates activated by electroacupuncture (EA) of different frequencies (II): Role of Fos/Jun proteins in EA-induced transcription of preproenkephalin and reprodynorphin genes. Brain Res Mol Brain Res. 1996;43(1-2):167-73.
[14] . Guo HF, Cui X, Hou Y, Tian J, Wang X, Han J. C-Fos proteins are not involved in the activation of preproenkephalin gene expression in rat brain by peripheral electric stimulation (electroacupuncture). Neurosci Lett.1996;207(3):163-6.
[15] . Choi BT, Lee JH, Wan Y, Han JS. Involvement of ionotropic glutamate receptors in low frequency electroacupuncture analgesia in rats. Neurosci Lett. 2005 Apr 4;377(3):185-8.
[16] . Choi BT, Kang J, Jo UB. Effects of electroacupuncture with different frequencies on spinal ionotropic glutamate receptor expression in complete Freund’s adjuvant-injected rat. Acta Histochem. 2005;107(1):67-76.
[17] . Han JS. Acupuncture: neuropeptide release produced by electrical stimulation of different frequencies. Trends Neurosci. 2003 Jan;26(1):17-22.
[18] . Sun RQ, Wang HC, Wan Y, Jing Z, Luo F, Han JS, et al. Suppression of neuropathic pain by peripheral electrical stimulation in rats: mu-opioid receptor and NMDA receptor implicated. Exp Neurol. 2004;187(1):23-9.
[19] . Wang Y, Zhang Y, Wang W, Cao Y, Han JS. Effects of synchronous or asynchronous electroacupuncture stimulation with low versus high frequency on spinal opioid release and tail flick nociception. Exp Neurol. 2005;192(1):156-62.
[20] . Lao L, Zhang RX, Zhang G, Wang X, Berman BM, Ren K. A parametric study of electroacupuncture on persistent hyperalgesia and Fos protein expression in rats. Brain Res. 2004;1020(1-2):18-29.
[21] . Almeida RT, Perez AC, Francischi JN, Castro MS, Duarte IDG. Opioidergic orofacial antinociception induced by electroacupuncture at acupoint St36. Brazilian Journal of Medical and Biological Research. [serial on the Internet]. [cited 2008 July 29]. Available from: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-879X2008005000028&lng=en&nrm=iso. In press 2008. doi: 10.1590/S0100-879X2008005000028
[22] . Huang C, Wang Y, Han JS, Wan Y. Characteristics of electroacupuncture-induced analgesia in mice: variation with strain, frequency, intensity and opioid involvement. Brain Res.2002;945(1):20-5.
[23] . Zhu JX, Tang JS, Jia H. Differential effects of opioid receptors in nucleus submedius and anterior pretectal nucleus in mediating electroacupuncture analgesia in the rat. Sheng Li Xue Bao. 2004;56(6):697-702.
[24] . Romita VV, Suk A, Henry JL. Parametric studies on electroacupuncture-like stimulation in a rat model: effects of intensity, frequency, and duration of stimulation on evoked antinociception. Brain Res Bull. 1997;42(4):289-96.
[25] . Romita VV, Yashpal K, Hui-Chan CW, Henry JL. Intense peripheral electrical stimulation evokes brief and persistent inhibition of the nociceptive tail withdrawal reflex in the rat. Brain Res. 1997 Jul 4;761(2):192-202.
[26] . Huang C, Hu ZP, Long H, Shi YS, Han JS, Wan Y. Attenuation of mechanical but not thermal hyperalgesia by electroacupuncture with the involvement of opioids in rat model of chronic inflammatory pain. Brain Res Bull. 2004;63(2):99-103.
[27] . Taguchi T, Taguchi R. Effect of varying frequency and duration of electroacupuncture stimulation on carrageenan-induced hyperalgesia. Acupunct Med. 2007;25(3):80-6.
[28] . Han JS, Li SJ, Tang J. Tolerance to electroacupuncture and its cross tolerance to morphine. Neuropharmacology. 1981;20(6):593-6.
[29] . Han J, Tang J, Huang B, Liang X, Zhang N. Acupuncture tolerance in rats: anti-opiate substrates implicated. Chin Med J (Engl). 1979;92(9):625-7.
[30] . Han JS, Ding XZ, Fan SG. Is cholecystokinin octapeptide (CCK-8) a candidate for endogenous anti-opioid substrates ? Neuropeptides. 1985 Feb;5(4-6):399-402.
[31] . Sautreuil P, Piquemal M. Acupuncture expérimentale. Acupuncture & Moxibustion. 2002;1(3-4):106-110.
[32] . Han JS. Cholecystokinin octapeptide (CCK-8) : a negative feedback control mechanism for opioid analgesie. Progress in Brain research. 1995;105:263-71.
[33] . Kim SK, Bae H, Lee G, Jeong H, Woo HS, Han JB, et al. The endogenous CCK mediation of electroacupuncture stimulation-induced satiety in rats. Peptides. 2008 Apr;29(4):564-70.
[34] . Tian JH, Xu W, Zhang W, Fang Y, Grisel JE, Mogil JS, et al. Involvement of endogenous orphanin FQ in electroacupuncture-induced analgesia. Neuroreport. 1997 Jan 20;8(2):497-500.
[35] . Tian JH, Zhang W, Fang Y, Xu W, Grandy DK, Han JS. Endogenous orphanin FQ: evidence for a role in the modulation of electroacupuncture analgesia and the development of tolerance to analgesia produced by morphine and electroacupuncture. Br J Pharmacol. 1998;124(1):21-6.
[36] . Tang NM, Dong HW, Wang XM, Tsui ZC, Han JS. Cholecystokinin antisense RNA increases the analgesic effect induced by electroacupuncture or low dose morphine: conversion of low responder rats into high responders. Pain. 1997;71(1):71-80.
[37] . Kim SK, Moon HJ, Park JH, Lee G, Shin MK, Hong MC, et al. The maintenance of individual differences in the sensitivity of acute and neuropathic pain behaviors to electroacupuncture in rats. Brain Res Bull. 2007;74(5):357-60.
[38] . Zhang RX, Wang L, Wang X, Ren K, Berman BM, Lao L. Electroacupuncture combined with MK-801 prolongs anti-hyperalgesia in rats with peripheral inflammation. Pharmacol Biochem Behav. 2005;81(1):146-51.
[39] . Zhang RX, Lao L, Wang X, Ren K, Berman BB. Electroacupuncture combined with indomethacin enhances antihyperalgesia in inflammatory rats. Pharmacol Biochem Behav. 2004;78(4):793-7.
[40] . Mi WL, Mao-Ying QL, Liu Q, Wang XW, Wang YQ, Wu GC. Synergistic anti-hyperalgesia of electroacupuncture and low dose of celecoxib in monoarthritic rats: involvement of the cyclooxygenase activity in the spinal cord. Brain Res Bull. 2008 Sep 30;77(2-3):98-104.
[41] . Wong RH, Lee TW, Sihoe AD, Wan IY, Ng CS, Chan SK, et al. Analgesic effect of electroacupuncture in postthoracotomy pain: a prospective randomized trial. Ann Thorac Surg. 2006;81(6):2031-6.
[42] . Zhang B, Luo F, Liu C. [Treatment of 121 heroin addicts with Han’s acupoint nerve stimulator]. Zhongguo Zhong Xi Yi Jie He Za Zhi. 2000;20(8):593-5.
[43] . Mu JP, Liu L, Hu J, Xu P. [Clinical study on electroacupuncture at Jiaji (EX-B2) for interfering protracted withdrawal syndrome in the patient of heroin dependence]. Zhongguo Zhen Jiu. 2005;25(9):599-602.
[44] . Jordan JB. Acupuncture treatment for opiate addiction: a systematic review. J Subst Abuse Treat. 2006;30(4):309-14.
[45] . Geng LL, Lin RS, Sun XY, Wu L, Zhong MM, Zhao B, et al. [Critical appraisal of randomized clinical trials in Chinese Acupuncture and Moxibustion from 2000 to 2006]. Zhongguo Zhen Jiu. 2008;28(6):439-43.