
Résumé : L’hypogalactie peut entraîner un arrêt de l’allaitement maternel avec pour conséquence des risques de morbidité pour le nourrisson. La thérapeutique usuelle passe par l’optimisation de la pratique de l’allaitement et un soutien psychologique de la mère. Selon les conceptions de la MTC et de la différenciation des syndromes (zheng), on distingue l’hypogalactie de type Plénitude (stase du qi du Foie) de celle de type Vide (Vide de qi et de Sang), principalement due à une carence de l’Estomac et du chongmai. Les essais contrôlés randomisés qu’ils soient de type pragmatique ou explicatif permettent de conclure que l’acupuncture peut s’intégrer idéalement dans le cadre d’une médecine intégrative. Mots clés : hypogalactie – acupuncture – prolactine – ocytocine – lactation – zheng – ECR pragmatique.
Summary: Hypogalactia may result in cessation of breastfeeding with the consequent risk of morbidity for the infant. The usual treatment involves the optimization of the practice of breastfeeding and counseling of the mother. According to the concepts of TCM and differentiation of syndromes (zheng), we distinguish the type hypogalactia Fullness (stagnation of Liver qi) of the type Deficiency (Deficiency of qi and blood), mainly due to a deficiency of the Stomach and chongmai. Randomized controlled trials that they are pragmatic or explanatory style can be concluded that acupuncture can fit ideally in the context of integrative medicine. Keywords: hypogalactia – acupuncture – prolactin – oxytocin – lactation – zheng – pragmatic RCT.

Comme l’engorgement mammaire étudié dans un précédent article [[1]], le défaut d’allaitement maternel et notamment l’hypogalactie voire l’agalactie sont des facteurs de risques de morbidité, voire de mortalité pour l’enfant. En effet, l’allaitement a un effet protecteur vis-à-vis des infections gastro-intestinales et dans une moindre mesure vis-à-vis des infections ORL et respiratoires. La France affiche un retard important quant à la pratique de l’allaitement maternel. En 2000, le pourcentage d’enfants allaités exclusivement par leur mère huit jours après la naissance était de 52,3 % et de 54,8 % en 2001. Le principal motif d’arrêt de la lactation des femmes avant neuf semaines est la perception d’une insuffisance de lait (38% des cas). Cela pourrait être davantage la conséquence de facteurs psychologiques et socioculturels et de pratiques inappropriées d’allaitement que d’une incapacité physiologique à produire suffisamment de lait. Ainsi dans les sociétés où l’allaitement est la norme, les échecs d’allaitement sont nettement moins fréquents.
La thérapeutique passe par l’optimisation de la pratique de l’allaitement associée à des encouragements et du soutien visant à restaurer la confiance de la mère dans ses capacités à satisfaire les besoins de son bébé. La stagnation staturo-pondérale du nourrisson sera évaluée afin d’identifier le retentissement de l’insuffisance des apports de lait maternel chez l’enfant [[2]]. L’acupuncture aurait-elle une place dans le contexte du panel de soins de la médecine intégrative ?
Rappel de la biologie de la lactation
Chez la femme, la montée laiteuse se produit environ quarante huit heures après l’accouchement, suite à l’expulsion du placenta, source importante d’hormones placentaires comme les estrogènes et la progestérone qui bloquent la fonction de lactation et d’éjection du lait jusqu’à l’accouchement. Dès cette expulsion, on observe une chute du taux d’œstradiol et surtout de progestérone qui va entraîner une libération de prolactine. Celle-ci est une hormone antéhypophysaire dont les concentrations sanguines varient en fonction du sexe et du stade physiologique et physiopathologique de l’individu. Pendant la grossesse, elle augmente progressivement pour atteindre 150 à 250 ng/ml. La libération de cette hormone est sous l’influence stimulatrice de la PRH (Prolactin Releasing Factor) et de la TRH (Thyrotropine Releasing Hormone). Elle est inhibée par la PIF (Prolactin Inhibiting Factor), identifiée comme étant la dopamine. Le tonus dopaminergique inhibiteur est continu, assurant l’inhibition de la libération d’une hormone par ailleurs à synthèse constante. Le contrôle de ce tonus permet en conséquence de moduler la sécrétion de prolactine. Trois facteurs sont donc nécessaires à la lactogénèse : un épithélium mammaire développé, une concentration très élevée de prolactine et une chute de la concentration d’estrogènes et de progestérone. Incidemment, dans certains cas de rétention placentaire, la montée laiteuse sera encore plus retardée. Il est à noter que le moment de la montée laiteuse ne dépend pas de la tétée par le nouveau-né mais bien des changements hormonaux associés à la parturition.
La lactogénèse est associée à une augmentation abrupte du volume de lait sécrété. En effet, celui-ci passe de 50 ml par jour au 2ème jour à environ 500 ml au 4ème jour. Il y a ensuite une augmentation graduelle pour atteindre environ 850 ml par jour 3 mois après l’accouchement. Deux hormones sont nécessaires pour le maintien de la sécrétion lactée : l’ocytocine et la prolactine (figure 1). L’ocytocine est nécessaire pour l’éjection du lait. La prolactine est essentielle pour maintenir la différenciation des cellules alvéolaires. La sécrétion de prolactine est augmentée pendant la tétée. Cette augmentation est proportionnelle à la force et la durée du stimulus de tétée. Le pic de prolactine lors de l’allaitement diminue à mesure que la lactation se prolonge. Néanmoins, les niveaux de prolactine semblent suffisants pour maintenir la lactation.
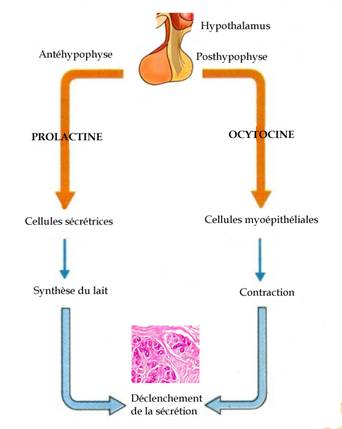
Figure 1. La mise en place de la lactation nécessite la prolactine (prolactogène) et l’ocytocine qui permet l’éjection du lait grâce à la contraction des cellules myoépithéliales. L’entretien de la lactation sera réalisé par l’action mécanique de la vidange (la tétée) entraînant un rétrocontrôle hypothalamo-hypophysaire avec augmentation à nouveau de la prolactine et de l’ocytocine.
Stratégies diagnostiques et thérapeutiques
Le sentiment d’insuffisance de production de lait, ou hypogalactie est très répandu chez les mères. Elles fondent ce sentiment sur des constatations diverses : seins mous, pleurs du bébé, selles moins fréquentes, seins qui ne coulent plus etc. En réalité, l’insuffisance de lait physiologique est très rare. Dans la majorité des cas, il s’agit soit de la perception d’une insuffisance de lait, soit d’une insuffisance de lait secondaire, conséquence d’une conduite inappropriée de l’allaitement due à des tétées inefficaces et peu nombreuses. Donc il s’agit bien souvent d’un phénomène transitoire et susceptible d’être corrigé par l’optimisation de la pratique de l’allaitement.
L’allaitement selon les conceptions de la Médecine Traditionnelle Chinoise
Dans un précédent article, a été montré que le chongmai a une forte influence sur les seins [1]. De même, le renmai, Mer des Méridiens yin, Vaisseau Conception, qui a un rôle essentiel autant durant la grossesse que durant l’accouchement, favorise la transformation des jinye (les Liquides Organiques), régule le Sang (xue) que le chongmai gouverne. La lactation est, selon Rempp, en rapport « avec le Sang, les jinye, mais aussi avec zhong qi (l’énergie du milieu de la poitrine), la Mer du qi et la Mer de la Nourriture » [[3]]. Ainsi le lait résulterait selon la MTC de la transformation du Sang sous l’action du chongmai et du renmai. « Tant qu’il y a allaitement, le Sang produit par la femme est transformé en lait » [3]. Wang Zhi Zhong (dynastie Song XIIème) dans le rouleau VII du Zhen Jiu Sheng Jing (Traité d’acupuncture et de moxibustion) propose d’utiliser le ES30 (qichong) en cas de difficulté de lactation ou le VC17 (shanzhong) en moxibustion si la montée laiteuse est insuffisante (Tong Ren) [[4]].
Maciocia distingue deux étiologies aux hypogalacties, toutes deux provoquées par une atteinte du chongmai. La première résulte d’une stase de son qi, c’est l’hypogalactie de type Plénitude ; la seconde est de type Vide en rapport à une déficience du Sang [[5]].
D’autres auteurs [3,[6-8] s’accordent à reconnaître selon la différenciation des syndromes (zheng) :
– une hypogalactie de type Plénitude liée à la stase du qi du Foie avec seins gonflés, tendus, douloureux, la langue est normale avec fin enduit jaune, le pouls tendu (xian) et glissant (hua) ;
– une hypogalactie de type Vide avec seins peu gonflés, mous et non douloureux en rapport avec un vide de qi et de Sang, principalement due à une carence de l’Estomac et du chongmai, la langue est pâle avec léger enduit, le pouls est fin (xi) et faible (ruo).
Les essais contrôlés randomisés en acupuncture
Les études cliniques pour évaluer l’action de l’acupuncture dans l’hypogalactie sont nombreuses et pratiquement toutes d’origine chinoise.
Par exemple, une étude de cinquante-quatre femmes présentant une insuffisance de lactation sont traitées par stimulation des points d’acupuncture, IG1 (shaoze), VC17 (shanzhong), ES18 (rugen), VE20 (pishu), ES36 (zusanli) et RA6 (sanyinjiao). Les résultats montrent que quarante-deux d’entres-elles bénéficièrent d’une amélioration significative de leur lactation, neuf eurent une petite amélioration et trois cessèrent le traitement [[9]]. De manière similaire mais traitant uniquement le zheng de déficience de qi et de Sang par injection de vitamine B12 sur les points VC17, ES18, VB21 (jianjing),VE20 et ES36, d’autres auteurs chinois ont observé un taux d’amélioration de l’hypogalactie de 96,8% [[10]].
Pelletier-Lambert dans une étude de cas sur l’engorgement mammaire suivi d’une insuffisance de lactation par un Vide de qi et de Sang préconise la puncture de VC17, IG1, VB41 (zulinqi) et ES36 [[11]].
ECR pragmatiques
Les ECR pragmatiques cherchent à vérifier l’efficacité d’une thérapeutique en la comparant au traitement de référence habituel. Son objectif vise donc à étudier une stratégie thérapeutique par rapport au traitement classique dans la pratique réelle sans qu’il n’y ait nécessairement un contrôle placebo et une intervention en aveugle (excepté éventuellement pour l’analyse des résultats) [[12],[13]]. Il doit y avoir un équilibre entre la validité interne (fiabilité des résultats dont on se rendra compte par exemple par les critères de Jadad) et la validité externe (généralisation ou reproductibilité des résultats). Dans un ECR pragmatique, il s’agira de répondre à la question : l’intervention peut-elle être utilisée efficacement dans ma réalité quotidienne ?
Ainsi un ECR multicentrique (n=276) en simple aveugle fut mis en place pour évaluer l’efficacité clinique du VC17 dans l’hypogalactie postpartum. Deux groupes : un groupe acupuncture et un groupe de phytothérapie chinoise (décoction Tongrutang, active selon la MTC sur l’hypogalactie). Le taux de prolactine mesuré avant et trois jours après traitement, est réduit significativement (p<0,05) dans le groupe phytothérapie, alors qu’il n’y a pas de différence significative dans le groupe acupuncture, objectivant la modulation de l’axe hypothalomo-hypophysaire. Dans les deux groupes, on observe une élévation significative de la lactation mais sans différence significative entre les deux groupes [[14]]. Cet ECR de bonne qualité méthodologique (Jadad à 3) est malheureusement sans groupe placebo comme souvent les ECR pragmatiques et compare l’acupuncture à une thérapeutique de phytothérapie de référence en Chine, mais non suffisamment évaluée en Occident. Le même ECR est paru également la même année en langue chinoise dans une autre revue [[15]].
Une autre étude a été réalisée en Italie en 2011 avec suivi jusqu’à trois mois après traitement. Quatre-vingt dix femmes ont été randomisées en deux groupes : groupe acupuncture (IG1, ES18, VC17 et points selon le zheng) et groupe conseils de soins habituels. En outre, en fonction de l’atteinte du zheng,les femmes du groupe « Vide de qi et de Sang » ont bénéficié de la puncture des points ES36, RA6 et VE20, alors que celles dont le diagnostic était « stase du qi du Foie » ont eu FO3 (taichong) et MC6 (neiguan) en plus. L’allaitement exclusif à 3 semaines était de 60% dans le groupe contrôle versus 100% dans le groupe acupuncture, différence significative (p <0,03). A trois mois on retrouvait 35% dans le groupe acupuncture versus 15% (p<0,03). Ces données préliminaires suggèrent que trois semaines de traitement d’acupuncture ont été plus efficaces que la seule observation des mesures de routine habituelle dans le maintien de l’allaitement jusqu’au troisième mois de la vie des nouveau-nés. Néanmoins, il faut tempérer ces bons résultats par le fait que cet ECR n’est pas en aveugle et qu’il existe de nombreux biais liés à l’attention portée aux femmes bénéficiant d’acupuncture et qu’enfin on ignore si le groupe acupuncture a bénéficié des soins habituels en plus de l’acupuncture [[16]].
ECR explicatifs
Les ECR explicatifs ont pour objectif d’essayer de comprendre l’origine de l’efficacité du traitement dans une situation idéale. De ce fait, la validité interne doit être forte et nécessite un groupe homogène de patients avec des critères d’inclusions stricts (à la différence des ECR pragmatiques, où ils sont plus larges), mais correspondant à des conditions souvent éloignées de la réalité. Dans l’ECR explicatif, il s’agira de répondre à la question : l’intervention peut-elle être efficace et fonctionner dans des conditions optimales [12,13] ?
Un autre ECR en 2008 a évalué l’efficacité du point IG1 (shaoze) dans l’insuffisance de lactation après accouchement en fonction de l’âge de la patiente mais aussi selon la différenciation des syndromes. Quatre-vingt-douze mères souffrant d’hypogalactie ont été randomisées dans un groupe traité IG1 (n=46) et un groupe témoin GI1 (n=46). Le groupe traitement IG1 a bénéficié d’électroacupuncture (EA) sur le point IG1 bilatéralement, alors que le groupe contrôle bénéficiait d’EA sur le point GI1 non indiqué dans la lactation. Le suivi a été réalisé sur un mois. Selon la différenciation des syndromes, les femmes (n=92) ont été classées selon deux zheng : déficience de qi et de Sang pour le premier sous-groupe et stase de qi de Foie pour le second ; et selon la classe d’âge : 20-29 ans et 30-39 ans. Les résultats montrent une efficacité statistiquement significative (p<0,01) de 100% dans le groupe traité versus 69,6% dans le groupe contrôle. Quel que soit le syndrome zheng et l’âge des patientes, le groupe traité par IG1 a obtenu de manière statistiquement significative (p<0,01) un meilleur effet que le groupe contrôle GI1 dans l’accroissement de la lactation. Par ailleurs le taux de prolactine se maintient dans le groupe traité alors qu’il diminue dans le groupe contrôle (p<0,01) [[17]]. Cet essai contrôlé randomisé est de bonne qualité méthodologique avec un score de Jadad à 3/5. Néanmoins certains critères méthodologiques ne sont pas décrits comme le calcul de la taille et de la puissance suffisante entre les deux groupes. De surcroît, ni les patients, ni les évaluateurs ne sont en aveugle alors qu’il s’agit non pas d’un ECR pragmatique, mais plutôt explicatif (acupuncture contre fausse acupuncture sur un point non spécifique visant à différencier l’effet spécifique de l’effet non spécifique). De ce fait, un ECR de plus grande puissance est nécessaire en simple ou double insu.
Cela semble avoir été réalisé par les mêmes auteurs dans cet autre ECR multicentrique en simple aveugle concernant 276 femmes. Ainsi le groupe EA (n=138) au point IG1 (shaoze) offre une amélioration de l’allaitement de 97,8% versus 24,3% dans le groupe contrôle GI1 (p<0,05). D’autre part, le groupe traitement montre une augmentation significative de la quantité de lait et un taux de prolactine meilleur que dans le groupe contrôle (p<0,01) [[18]]. Malheureusement cet ECR explicatif en langue chinoise ne peut être analysé.
Le tableau I récapitule toutes ces études.
Tableau I. Principales études de l’hypogalactie et leurs caractéristiques (bonne qualité méthodologique si Jadad > 3).
| Auteur (année, pays) | Type d’étude et population | Jadad | Groupe intervention Traitement | Résultats sur l’hypogalactie | Commentaires |
| Wang (2004, Chine) | Étude de cas (N=54) | 0 | IG1, VC17, ES18, VE20, ES36, RA6 (recherche deqi) : séance de 30mn Moxibustion 20mn sur ES18 et VC17 (1 séance/j durant 11 jours) | Efficacité : 78% Amélioration : 16% Échec : 6% | Au niveau le plus bas de la hiérarchie classique de la force des preuves |
| Tian (1998, Chine) | Étude de cas (N=63) | 0 | Vide de qi et de Sang :VC17, ES18, VB21, VE20 et ES36 (recherche deqi) Injection sur les points 0,5mg Vitamine B121 séance 1 jour sur 2 (6-8 séances) | Efficacité : 89% Amélioration : 8% Échec : 3% | Au niveau le plus bas de la hiérarchie classique de la force des preuves |
| Huang (2008, Chine) | ECR pragmatique, parallèle, multicentrique en simple aveugle (N=276) | 3 | 1. groupe Acu (n=138) : VC17 (EA 2,5 Hz 1 fois / j pendant 3 jours) 2. groupe phytothérapie (n=138) : décoction Tongrutang (Fructus Liquidambaris : 15g ; Radix Angelicae Sinensis 15g Semen Vaccariae 15g Radix Codonopsis 15g Rhizoma Cyperi 15g) | Équivalence d’efficacité sur la lactation dans les deux groupes | – Pas de groupe placebo – étude en intention de traiter non précisé – critère de succès du groupe phytothérapie non évalué |
| Neri (2011, Italie) | ECR pragmatique, parallèle, sans insu (N=90) | 3 | 1. groupe acupuncture-traitement commun : IG1, ES18 et VC17 – vide de qi et de Sang : ES36, RA6 et VE20 – stase du qi du Foie : FO3, MC62. groupe conseils de soins habituels Traitement de trois semaines : 2 fois par semaine Suivi : 3 mois | – Efficacité 100% à 3 semaines supérieure (p <0,03) au groupe contrôle (60%) – A 3 mois : 35% versus 15% (p<0,03) dans le groupe contrôle. -Acupuncture supérieure aux conseils de soins habituels | – ECR non en aveugle en intention de traiter – biais liés à l’attente des femmes |
| Wei (2008, Chine) | ECR analytique, parallèle, sans insu (N=92) | 3 | 1. groupe Acu IG1 avec deqi (n=46) – vide de qi et de Sang (n=27) – stase de qi de Foie (n=19) EA 30 minutes après (20 Hz, 0,1A) 1 fois par jour : 5 jours, puis renouvellement de la session après un intervalle libre de 2 jours 2. groupe contrôle GI1 (n=46) : même stratégie de session suivi : 1 mois | Efficacité 100% dans groupe IG1 versus 69,6% groupe contrôle (p<0,01) | – groupe contrôle sur un point non actif pouvant être considéré point placebo- ECR non en aveugle -établit la spécificité de l’IG1 dans l’hypogalactie |
| Wang (2007, Chine) | ECR analytique, parallèle, multicentrique en simple aveugle (N=276) | ? | 1. groupe EA (n=138) IG1 (shaoze) 2. groupe contrôle GI1 (n=138) | Efficacité de l’allaitement de 97,8% versus 24,3% dans le groupe contrôle (p<0,05). | -ECR en langue chinoise, excepté le résumé – établit la spécificité de l’IG1 dans l’hypogalactie |
En conclusion, il semble que l’acupuncture possède des effets thérapeutiques sur l’allaitement. Cependant l’évaluation méthodologique montre de nombreux biais et il faudra attendre des ECR répondant aux normes CONSORT [[19]] et STRICTA [[20]] pour recommander l’acupuncture dans l’hypogalactie.
Réalité de la spécificité du point IG1 ?
A la lecture des deux ECR chinois, il semble que le point IG1 (shaoze) favorise spécifiquement la lactation après accouchement, essentiellement dans la stase de qi du Foie, comme il est indiqué empiriquement dans la littérature de MTC [5,7]. Jenner et Filshie [[21]] objectivent d’ailleurs un épisode de galactorrhée du sein gauche six jours après puncture de trigger points sur le muscle suprascapulaire et surtout infraépineux droit (correspondant au point IG11 tianzong, point indiqué pour promouvoir aussi la lactation) et GI4 (hegu) gauche. Cette femme mastectomisée suite à un cancer du sein droit et n’ayant pas allaité depuis quatre ans bénéficiait d’acupuncture à visée antalgique dans le cadre d’algies axillaires droites irradiant vers le coude. Il était reporté aussi une élévation de prolactine et d’ocytocine, malheureusement non documentée avant l’intervention acupuncturale. Cette étude de cas semblait donc confirmer la théorie de la spécificité de certains points connus pour leur effet dans la lactation.
Pourtant, suite à l’observation d’une patiente de 33 ans n’ayant pas allaité depuis 12 mois et traitée pour algie du pied gauche, cette théorie semblait être infirmée. En effet, une galactorrhée ipsilatérale survenait quelques heures après la puncture au niveau du métatarse et des phalanges de l’hallux. Les auteurs concluaient à la non-spécificité de l’action de l’acupuncture du fait que la puncture en dehors de l’IG11 pouvait entraîner aussi une galactorrhée [[22]]. Ils n’avaient peut-être pas noté que la zone du métatarsien du gros orteil correspond au Méridien zutaiyin et en particulier au gongsun (RA4), point clé du chongmai qui est fortement impliqué dans la grossesse. D’où la puncture du point clé du chongmai pourrait, selon la physiopathologie de la MTC résumée plus haut, intervenir dans la physiologie de l’allaitement, même si d’un point de vue neurophysiologique occidentale, ce point ne fait pas du tout partie du métamère en rapport avec le sein.
D’un point de vue expérimental, il a été objectivé sur le rat que l’acupuncture pouvait entraîner une sécrétion de prolactine [[23]]. Sheng et coll. objectivent d’ailleurs que la puncture du point VC17 (shanzhong) augmente, toujours chez la rate allaitante, le taux de prolactine par l’intermédiaire des catécholamines (la noradrénaline du système nerveux central) et de l’acide gamma amino butyrique (GABA) [[24]]. Cela a été aussi démontré chez la parturiente par stimulation d’un acupoint mais cette fois par massage tuina [[25]].
L’ocytocine qui est nécessaire pour l’éjection du lait est également stimulée par acupuncture. On connaît ainsi de nombreux travaux qui montrent sa libération par stimulation acupuncturale avec pour effet une action analgésique et anxiolytique [26-29]. Par contre, il n’existe pas à l’heure actuelle de travaux montrant la contribution de l’acupuncture à la lactation même si des analogies peuvent être objectivées [[30]].
Conclusion
L’insuffisance de lait physiologique est très rare. Dans la majorité des cas, l’optimisation de la pratique de l’allaitement et les encouragements visant à restaurer la confiance de la mère permettent de rétablir la situation. Cependant, l’acupuncture semble offrir une possibilité non négligeable d’accélérer le rétablissement de l’allaitement sans nécessité de recourir à l’alimentation de substitution. Bien sûr les preuves actuelles fournies dans l’hypogalactie proviennent d’études de faible qualité et, comme souvent en acupuncture, médecine encore nouvelle dans la perspective factuelle et scientifique, de nouveaux ECR de haute qualité méthodologique sont souhaités.

Références
[1]. Stéphan JM. L’acupuncture en suite de couches : engorgement mammaire et mastite. Acupuncture & Moxibustion. 2011;10(3):180-185.
[2]. Agence nationale d’accréditation et d’évaluation en santé. Allaitement maternel – Mise en oeuvre et poursuite dans les 6 premiers mois de vie de l’enfant. Paris: ANAES ; mai 2002. Available from: URL: http://www.has-sante.fr/portail/jcms/c_267550/allaitement-six-premiers-mois-rapport-completpdf.
[3]. Rempp C, Bigler A. La pratique de l’acupuncture en obstétrique. Paris: Ed. La Tisserande; 1992.
[4]. Wang Zhi Zhong, traducteurs Guillaume G et Mach-Chieu. Zhen Jiu Zi Sheng Jing. Traité d’acupuncture et de moxibustion, l’entretien de la vie. Gap: Editions Désiris;2011.
[5]. Maciocia G. Les principes fondamentaux de la médecine chinoise. 2nd ed. Issy-les-Moulineaux: Elsevier Masson; 2008
[6]. Truong tan Trung. Les maladies bénignes du sein. Revue Française de MTC. 1996;169:30-34.
[7]. Deadman P, Al-Khafaji M. Manuel d’acupuncture. Bruxelles: Satas; 2003.
[8]. Mazel-Gee, Gee PS. Deficient lactation. Journal of the american college of traditional chinese medicine.1985;1:38-40.
[9]. Wang YF, Li XY. Treatment of 54 cases of lactation insufficiency with acupuncture. J. Acupuncture & tuina Science. 2004;2(2):53.
[10]. Tian J. 63 cases of hypogalactia due to deficiency of qi and blood treated by acupoint-injection. World journal of acupuncture-moxibustion. 1998;8(2):23-5.
[11]. Pelletier-Lambert A. Engorgement mammaire. Acupuncture & Moxibustion. 2004;3(3):191-2.
[12]. Godwin M, Ruhland L, Casson I, MacDonald S, Delva D, Birtwhistle R, Lam M, Seguin R. Pragmatic controlled clinical trials in primary care: the struggle between external and internal validity. BMC Med Res Methodol. 2003 Dec 22;3:28.
[13]. Treweek S, Zwarenstein M. Making trials matter: pragmatic and explanatory trials and the problem of applicability. Trials. 2009 Jun 3;10:37.
[14]. Huang T, Chen BY, He JQ et al. Study on clinical efficacy of needling danzhong (CV 17) in treating postpartum hypogalactia. Journal of acupuncture and tuina science. 2008;6(1):27-31.
[15]. He JQ, Chen BY, Huang T, Li N, Bai J, Gu M, Yu M, He XP, Wang HY. [Randomized controlled multi-central study on acupuncture at Tanzhong (CV 17) for treatment of postpartum hypolactation]. Zhongguo Zhen Jiu. 2008 May;28(5):317-20.
[16]. Neri I, Allais G, Vaccaro V, Minniti S, Airola G, Schiapparelli P, Benedetto C, Facchinetti F. Acupuncture treatment as breastfeeding support: preliminary data. J Altern Complement Med. 2011 Feb;17(2):133-7.
[17]. Wei L, Wang H, Han Y, Li C. Clinical observation on the effects of electroacupuncture at Shaoze (SI 1) in 46 cases of postpartum insufficient lactation. J Tradit Chin Med. 2008 Sep;28(3):168-72.
[18]. Wang HC, An JM, Han Y, Huang LN, Zhao JW, Wei LX, et al. [Multicentral randomized controlled studies on acupuncture at Shaoze (SI 1) for treatment of postpartum hypolactation]. Zhongguo Zhen Jiu. 2007 Feb;27(2):85-88.
[19]. Begg C, Cho M, Eastwood S, Horton R, Moher D, Olkin I, et al. Improving the quality of reporting of randomized controlled trials. The CONSORT statement. Jama. 1996 Aug 28;276(8):637-9.
[20]. MacPherson H, White A, Cummings M, Jobst KA, Rose K, Niemtzow RC. Standards for Reporting Interventions in Controlled Trials of Acupuncture: the STRICTA recommendations. J Altern Complement Med. 2002;8(1):85-9.
[21]. Jenner C, Filshie J. Galactorrhoea following acupuncture. Acupunct Med. 2002 Aug;20(2-3):107-8.
[22].Campbell A, Macglashan J. Acupuncture-induced galactorrhoea–a case report. Acupunct Med. 2005 Sep;23(3):146.
[23]. Xie QW, Liu J. Effect of acupuncture on prolactin secretion of lactating rats. Zhen Ci Yan Jiu. 1986;11(4):303-7.
[24]. Sheng PL, Xie QW. Relationship between effect of acupuncture on prolactin secretion and central catecholamine and R-aminobutyric acid. Zhen Ci Yan Jiu. 1989;14(4):446-51.
[25]. Lu P, Qiu J, Yao F, Zheng JJ. [Effect of acupoint Tuina on lactation amount for parturient]. Zhongguo Zhen Jiu. 2010 Sep;30(9):731-3.
[26]. Yang J, Yang Y, Chen JM, Liu WY, Wang CH, Lin BC. Effect of oxytocin on acupuncture analgesia in the rat. Neuropeptides. 2007 Oct;41(5):285-92.
[27]. Carlsson C. Acupuncture mechanisms for clinically relevant long-term effects–reconsideration and a hypothesis. Acupunct Med. 2002 Aug;20(2-3):82-99.
[28]. Song CY, Liu WY, Gu XY, Lin BC. [Effect of anti-opioid peptide sera on oxytocin-induced enhancement of electroacupuncture analgesia]. Sheng Li Xue Bao. 1993 Jun;45(3):231-6.
[29]. Song CY, Liu WY, Yang J, Lin BC, Zhu HN. [The role of central oxytocin in electroacupuncture analgesia]. Sheng Li Xue Bao. 1990 Apr;42(2):169-74.
[30]. Caldwell JD, Walker CH, O’Rourke ST, Faggin BM, Morris M, Mason GA. Analogies between oxytocin systems of the uterus and brain. Horm Metab Res. 1996 Feb;28(2):65-74.