
Résumé : Introduction. L’IA modernise l’électroacupuncture, technique issue de l’acupuncture et de la médecine traditionnelle chinoise, en rendant ses pratiques plus objectives, standardisées et mesurables, facilitant ainsi leur intégration dans la médecine conventionnelle. Méthodologie. Les approches incluent : l’analyse bibliométrique de la littérature, l’extraction de données cliniques par IA (apprentissage automatique - machine learning et apprentissage profond - deep learning), l’utilisation de périphériques reliés à des ordinateurs pour standardiser les gestes, et l’intégration d’outils d’analyse automatique des signaux biologiques (EEG, EMG). Résultats. L’IA permet de standardiser les paramètres de l’EA et améliorer la reproductibilité des traitements ; de prédire l’efficacité clinique (par exemple améliore la récupération fonctionnelle comme la paralysie faciale, récupération intestinale postopératoire, etc.) et personnaliser les protocoles ; d’objectiver les effets physiologiques (l’IA révèle que l’EA agit principalement via des voies neuro-immunes comme l’axe vagal, l’axe hypothalamo–hypophyso–surrénalien (HPA), NF-κB, etc., effets quantifiables par des biomarqueurs numériques) et enfin d’accélérer la recherche de nouveaux traitements et l’utilisation de la robotique à l’acupuncture. Les limites principales sont l’hétérogénéité des données et le manque de protocoles validés. L’IA facilite la standardisation des protocoles et l’évaluation objective des résultats, tout en restant un outil d’aide à la décision et non un substitut au clinicien. Conclusions. L’IA apparaît comme un levier majeur pour transformer l’EA et la médecine chinoise, en rendant les traitements plus objectifs, personnalisés et scientifiquement crédibles. Elle ouvre la voie à des protocoles adaptatifs, monitorés à distance, mais ne remplace pas l’expertise clinique humaine. Toutefois, des défis persistent, notamment l’hétérogénéité des données, le manque de protocoles validés et la nécessité de validations multicentriques. Mots-clés : Intelligence artificielle (IA) - Electroacupuncture (EA) – apprentissage automatique et profond – robotique.
Applications of Artificial Intelligence (AI) to electroacupuncture (EA)
Abstract: Introduction. AI is modernizing electroacupuncture, a technique derived from acupuncture and traditional Chinese medicine, by making its practices more objective, standardized, and measurable, thus facilitating their integration into conventional medicine. Methodology. The approaches include: bibliometric analysis of the literature, extraction of clinical data using AI (machine learning, deep learning), the use of computer-connected devices to standardize movements, and the integration of automatic analysis tools for biological signals (EEG, EMG). Results. AI makes it possible to standardize EA parameters and improve the reproducibility of treatments; to predict clinical efficacy (e.g., improves functional recovery such as facial paralysis, postoperative bowel recovery, etc.) and personalize protocols; to objectify the physiological effects (AI reveals that EA acts primarily via neuro-immune pathways such as the vagal axis, the hypothalamic-pituitary-adrenal (HPA) axis, NF-κB, etc., effects quantifiable by digital biomarkers) and finally to accelerate the search for new treatments and the use of robotics in acupuncture. The main limitations are the heterogeneity of the data and the lack of validated protocols. AI facilitates the standardization of protocols and the objective evaluation of results, while remaining a decision-support tool and not a substitute for the clinician. Conclusions. AI appears as a major lever for transforming EA and Chinese medicine, making treatments more objective, personalized, and scientifically credible. It paves the way for adaptive protocols, monitored remotely, but does not replace human clinical expertise. However, challenges remain, including data heterogeneity, a lack of validated protocols, and the need for multicenter validation. Keywords: Artificial intelligence (AI) - Electroacupuncture (EA) – deep and machine learning - robotics.
Introduction
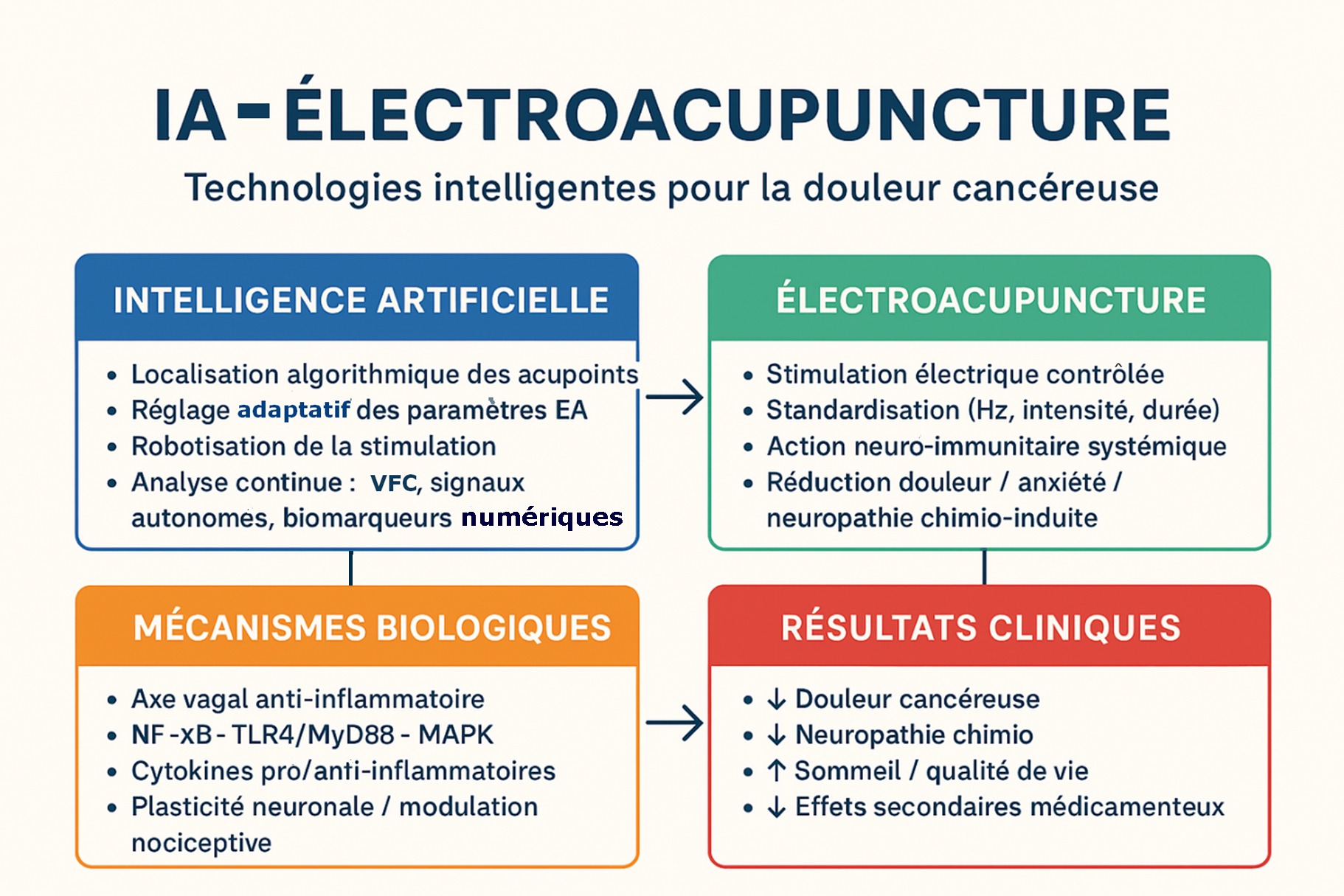
En 2022, Wang et coll. ont réalisé une synthèse exhaustive des usages de l’IA appliquée à l’acupuncture avec pour objectif de moderniser, d’objectiver et standardiser une pratique historiquement fondée sur l’expertise clinique [1].
Les domaines d’application de l’IA identifiés selon ces auteurs sont :
- sélection et prescription des points d’acupuncture par exploration de données (« data mining » qui désigne l’ensemble des méthodes qui permettent d’extraire des informations utiles à partir de grandes quantités de données). L’IA va analyser de larges bases de données cliniques et bibliographiques afin d’identifier les combinaisons d’acupoints optimales pour des pathologies spécifiques (douleur, troubles neurologiques, digestifs, etc.). Il y aura un apport majeur selon l’objectivation scientifique de prescriptions traditionnellement empiriques.
- reconnaissance et standardisation des manipulations : couplée à des capteurs et à la vision par ordinateur, l’IA analyse les signaux (force, fréquence, amplitude), distinguent les techniques (rotation, levée‑enfoncement), enregistre les gestes d’experts et améliore la reproductibilité. Tout ceci peut être une étape clé vers une standardisation technique de l’acupuncture et de l’EA.
- prédiction de l’efficacité clinique par apprentissage supervisé (principalement SVM[1]) avec par exemple les données d’entrée comme l’imagerie cérébrale (IRMf), ou la connectivité fonctionnelle, ou les paramètres cliniques. L’objectif est donc de prédire les répondeurs à l’acupuncture / EA et de soutenir une médecine personnalisée.
[1]. L’usage de l’apprentissage supervisé « machine learning supervisé », et en particulier des machines à vecteurs de support (SVM), désigne une approche où un algorithme apprend à reconnaître ou prédire un résultat à partir d’exemples déjà étiquetés. La « machine learning supervisé » repose sur trois éléments clés : des données d’entrée (appelées features), par exemple : signaux EEG ou EMG, paramètres cliniques, images médicales ; une étiquette connue associée à chaque donnée : répondeur / non‑répondeur, avant / après traitement, pathologique / sain. Une SVM est un algorithme de machine learning supervisé utilisé pour : la classification (le plus fréquent), la régression (plus rare en clinique). Son principe fondamental est de séparer les données en classes en trouvant la frontière optimale entre elles. Exemple concret en électroacupuncture : dans les études EA + IA, on pourra avoir en entrées, les caractéristiques EEG (puissance alpha, connectivité), les paramètres de stimulation EA ; les étiquettes : amélioration clinique oui/non, groupe EA vs contrôle. Bref, la SVM apprend à distinguer les profils répondants, en fournissant une probabilité de réponse. Mais la SVM n’administre pas le traitement, elle aide donc à l’analyse et à la prédiction.
Pour en savoir plus et lire l'article complet, veuillez-vous cliquer en haut et à droite de l'écran sur l'icône des 3 barres horizontales.
Puis entrez votre identifiant et mot de passe fourni lors de votre abonnement par l'intermédiaire de l'ASMAF-EFA ou en vous abonnant à cet endroit.
|
Dr Jean-Marc Stéphan Président de l’association et de la revue « Acupuncture & Moxibustion » Secrétaire général de l’ASMAF-EFA * ORCID : 0000-0002-3377-2280 Conflit d’intérêts : aucun
|
Dr Tuy Nga Brignol Vice-Présidente de l’ASMAF-EFA Rédactrice en chef de la revue « Acupuncture & Moxibustion » * ORCID : 0000-0002-3775-1209 Conflit d’intérêts : aucun
|
|
Points essentiels · Modernisation et objectivation de l’EA : L’IA transforme l’électroacupuncture, en rendant ses pratiques plus objectives, mesurables et standardisées, ce qui facilite leur intégration dans la médecine conventionnelle. · Diversité des méthodologies : Une variété de méthodes innovantes est présentée : analyse bibliométrique, extraction de données cliniques par IA, utilisation de capteurs et de vision par ordinateur, et analyse automatique des signaux biologiques (EEG, EMG). · Standardisation et personnalisation des traitements : L’IA permet de standardiser les paramètres de l’EA, d’améliorer la reproductibilité, de prédire l’efficacité clinique et de personnaliser les protocoles selon les besoins du patient. · Objectivation des effets physiologiques : L’IA révèle les mécanismes d’action de l’EA, notamment via des voies neuro-immunes, et quantifie les effets grâce à des biomarqueurs numériques. · Applications cliniques multiples : L’IA a été utilisée dans des essais cliniques pour la récupération post-chirurgicale, la douleur oncologique, la maladie de Parkinson et la paralysie faciale. · Robotisation et automatisation : L’IA permet la création de systèmes autonomes et la robotisation de l’acupuncture, réduisant la variabilité inter-opérateurs. · Analyse bibliométrique avancée : L’IA cartographie les tendances de la recherche mondiale et identifie les axes émergents. · Renforcement institutionnel : L’IA contribue à la reconnaissance institutionnelle de l’EA et des techniques associées. · Vision intégrative et prospective : On insiste sur le rôle de l’IA comme levier pour une médecine chinoise plus scientifique, précise et crédible, ouvrant la voie à des protocoles adaptatifs et monitorés à distance, sans remplacer l’expertise clinique humaine. · Identification des limites et des défis : Il faudra néanmoins tenir compte des obstacles actuels présents qui sont : hétérogénéité des données, manque de protocoles validés, et nécessité de validations multicentriques, ce qui montre une approche critique et réaliste. Mais on comprendra que l’importance dorénavant de l’apport de l’IA à l’électroacupuncture et à la médecine traditionnelle chinoise, tant sur le plan méthodologique que clinique.
|
|
Key Points |
|
|
|
• Modernization and objectification of EA: AI is transforming electroacupuncture, making its practices more objective, measurable, and standardized, thus facilitating their integration into conventional medicine. |
|
|
• Diversity of methodologies: A variety of innovative methods are presented: bibliometric analysis, AI-powered clinical data extraction, use of sensors and computer vision, and automated analysis of biological signals (EEG, EMG). |
|
|
• Standardization and personalization of treatments: AI enables the standardization of EA parameters, improves reproducibility, predicts clinical efficacy, and personalizes protocols according to patient needs. |
|
|
• Objectification of physiological effects: AI reveals the mechanisms of action of EA, particularly via neuro-immune pathways, and quantifies the effects using digital biomarkers. |
|
|
• Multiple clinical applications: It has supported clinical trials involving post-surgical recovery, cancer pain management, Parkinson’s disease, and facial paralysis. |
|
|
• Robotics and Automation: AI enables the creation of autonomous systems and the robotization of acupuncture, reducing inter-operator variability. |
|
|
• Advanced Bibliometric Analysis: AI maps global research trends and identifies emerging areas. |
|
|
• Institutional Strengthening: AI contributes to the institutional recognition of electroacupuncture (EA) and related techniques. |
|
|
• Integrative and Forward-Looking Vision: Emphasis is placed on the role of AI as a lever for a more scientific, precise, and credible Chinese medicine, paving the way for adaptive and remotely monitored protocols, without replacing human clinical expertise. |
|
|
• Identifying Limitations and Challenges: It will nevertheless be necessary to consider the current obstacles, which include: data heterogeneity, a lack of validated protocols, and the need for multicenter validation, demonstrating a critical and realistic approach. However, the importance of AI's contribution to electroacupuncture and traditional Chinese medicine, both methodologically and clinically, is now clear. |
Références
[1]. Wang Y, Shi X, Efferth T, Shang D. Artificial intelligence-directed acupuncture: a review. Chin Med. 2022 Jun 28;17(1):80. doi: 10.1186/s13020-022-00636-1.
[2]. Zhou Q, Zhao T, Feng K, Gong R, Wang Y, Yang H. Artificial intelligence in acupuncture: A bibliometric study. Math Biosci Eng. 2023 Apr 27;20(6):11367-11378. doi: 10.3934/mbe.2023504. PMID: 37322986.
[3]. Zhang YY, Chen QL, Wang Q, Ding SS, Li SN, Chen SJ, Lin XJ, Li CD, Asakawa T. Role of Parameter Setting in Electroacupuncture: Current Scenario and Future Prospects. Chin J Integr Med. 2022 Oct;28(10):953-960. doi: 10.1007/s11655-020-3269-2
[4]. Wu HT, Wu HK, Wang CL, Yang YL, Wu WH, Tsai TH, Chang HH. Modeling the Pulse Signal by Wave-Shape Function and Analyzing by Synchrosqueezing Transform. PLoS One. 2016 Jun 15;11(6):e0157135. doi: 10.1371/journal.pone.0157135.
[5]. Lin, H., Ning, Z., Zhang, C. et al. Computerized tongue image analysis for non-invasive disease screening: a review. Chin Med 20, 196 (2025). https://doi.org/10.1186/s13020-025-01242-7
[6]. Cai Y, Li H, Nan H, Xu P, Li J, Pan H, Wang H, Ge M, Guan J, Jiang Z, Wang G. Randomized Trial on Electroacupuncture for Recovery of Postoperative Gastrointestinal Function Based on Long-Term Monitoring Device. Ann Surg Oncol. 2025 Jul;32(7):5165-5172. doi: 10.1245/s10434-025-17239-3.
[7]. Cheshire WP, Freeman R, Gibbons CH, Cortelli P, Wenning GK, Hilz MJ, Spies JM, Lipp A, Sandroni P, Wada N, Mano A, Ah Kim H, Kimpinski K, Iodice V, Idiáquez J, Thaisetthawatkul P, Coon EA, Low PA, Singer W. Electrodiagnostic assessment of the autonomic nervous system: A consensus statement endorsed by the American Autonomic Society, American Academy of Neurology, and the International Federation of Clinical Neurophysiology. Clin Neurophysiol. 2021 Feb;132(2):666-682. doi: 10.1016/j.clinph.2020.11.024. Epub 2020 Dec 22. Erratum in: Clin Neurophysiol. 2021 May;132(5):1194. doi: 10.1016/j.clinph.2021.02.006. PMID: 33419664.
[8]. Kong X, Liu T, Wei J. Parkinson's Disease: The Neurodegenerative Enigma Under the "Undercurrent" of Endoplasmic Reticulum Stress. Int J Mol Sci. 2025 Apr 3;26(7):3367. doi: 10.3390/ijms26073367.
[9]. Zhang Q, Yang H, Li P, Zhou X, Wang Y. Electroacupuncture attenuates endoplasmic reticulum stress–mediated apoptosis via PERK/eIF2α pathway in a rat model of Parkinson’s disease. Brain Res. 2019;1712:146‑153.
[10]. Liu W, Wang X, Yang S, Chen Y, Zhang J. Electroacupuncture alleviates endoplasmic reticulum stress by regulating GRP78 and CHOP in MPTP‑induced Parkinsonian mice. Acupunct Med. 2021;39(3):211‑219.
[11]. Wang H, Pan Y, Xue B, Wang X, Zhao F, Zhang J, et al. Electroacupuncture improves motor function and attenuates endoplasmic reticulum stress in a 6‑OHDA rat model of Parkinson’s disease. Neural Regen Res. 2020;15(9):1701‑1708.
[12]. Shi Z, Sun H, Wu J, Jin Y, Cao S, Cai J. Chinese acupoint therapies in cancer pain management: research advances and future perspectives. Pain Manag. 2025 Jun;15(6):345-358. doi: 10.1080/17581869.2025.2510191.
[13]. Li YC, Yu Y, Qiao X, Ren LJ, Xu JW, Wang X, Gu W, Yao W. A robot arm-assisted acupuncture system with motion and force monitoring: establishment and validation. Front Bioeng Biotechnol. 2025 Aug 6;13:1563263. doi: 10.3389/fbioe.2025.1563263.
[14]. Zhu P, Wang H, Zhang L, Jiang X. Deep Learning-Based Surface Nerve Electromyography Data of E-Health Electroacupuncture in Treatment of Peripheral Facial Paralysis. Comput Math Methods Med. 2022 May 31;2022:8436741. doi: 10.1155/2022/8436741.
[15]. Li T, Wang S, Yin X, Zhang S, Yang Z, Wu J, Huang Z. Electroacupuncture with intermittent wave stimulation as rehabilitation approach for chronic Bell's palsy: a randomized controlled trial. Postgrad Med J. 2024 Feb 15;100(1181):151-158. doi: 10.1093/postmj/qgad126. PMID: 38134327.
[16]. Brignol TN. La manipulation des aiguilles pour l’obtention du deqi est une composante essentielle à l’efficacité de l’acupuncture dans le traitement de la paralysie de Bell. Acupuncture & Moxibustion. 2013 ;12(2):138-143.
[17]. Paturel F. Stéphan JM. Hawawini R. À propos d’une paralysie de Bell : efficacité de l’acupuncture et de l’électroacupuncture : étude synthétique. Acupuncture & Moxibustion. 2021;20(1):23-31.
[18]. Liu C, Liu S, Wang Y, Xia X, Zhang Y, Jiang H, Bao T, Ma X. A comprehensive overview of acupuncture therapy over the past 20 years: Machine learning-based bibliometric analysis. Complement Ther Med. 2025 Mar;88:103110. doi: 10.1016/j.ctim.2024.103110.









